JEMVY 20 mg/0.4 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör (1 enjektör) Kısa Ürün Bilgisi
{ Ofatumumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
JEMVY 20 mg/0,4 mL enjeksiyonluk çözelti içeren kullanıma hazır enjektör Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir kullanıma hazır enjektör 0,4 mL çözeltide etkin madde olarak 20 mg ofatumumab içerir (50 mg/ml).
Ofatumumab rekombinant DNA teknolojisi ile bir murin hücre hattında (NS0) üretilen tamamen insan bir anti-CD20 monoklonal antikordur.
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti
Çözelti berrak ila hafif bulanık ve renksiz ila hafif kahverengimsi-sarı renktedir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
JEMVY, multipl sklerozun relapsla seyreden formlarının (RMS) görüldüğü erişkinlerin tedavisi için endikedir (bkz. Bölüm 5.1).
4.2. Pozoloji ve uygulama şekli
JEMVY, nörolojik koşulların kontrolünde deneyimli bir doktor tarafından başlatılmalıdır.
Pozoloji/uygulama sıklığı ve süresi
Önerilen doz, aşağıdaki şekilde subkutan enjeksiyon ile uygulanan 20 mg JEMVY'dir:
0, 1 ve 2. haftalarda başlangıç dozunun ardından
4. haftadan itibaren ardışık aylık doz uygulama.
Unutulan dozlar
Eğer bir JEMVY enjeksiyonu kaçırılırsa, kaçırılan doz bir sonraki planlı doza kadar beklemeden mümkün olan en kısa zamanda uygulanmalıdır. Ardışık dozlar önerilen aralıklarda uygulanmalıdır.
Uygulama şekli
JEMVY subkutan uygulama ile hasta tarafından kendi kendine uygulamaya yöneliktir.
Subkutan enjeksiyon için olağan bölgeler karın, uyluk ve üst dış koldur.
İlk JEMVY enjeksiyonu bir sağlık uzmanı rehberliğinde yapılmalıdır (bkz. Bölüm 4.4). Uygulama için kapsamlı açıklamalar kullanma talimatında sunulmaktadır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda doz modifikasyonu gerekmesi beklenmemektedir (bkz.
Bölüm 5.2).
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda doz modifikasyonu gerekmesi beklenmemektedir (bkz. Bölüm 5.2).
Pediatrik popülasyon:
JEMVY'nin 0 ila 18 yaşındaki çocuklarda güvenliliği ve etkililiği henüz belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon:
55 yaş üzerindeki MS hastalarında hiçbir çalışma yürütülmemiştir. Devam eden klinik çalışmada yer alan hastalarda, 55 yaşına erişmelerinden sonra ayda bir 20 mg ofatumumab dozu sürdürülecektir. Mevcut kısıtlı veriler temelinde 55 yaş üzerindeki hastalarda doz ayarlaması gerekli görülmemektedir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
JEMVY, etkin maddeye veya 6.1 bölümünde listelenen yardımcı maddelerden herhangi birine karşılık aşırı duyarlılığı olan hastalarda kontrendikedir.
İmmünitesi ciddi şekilde zayıflamış olan hastalar
Düzelene kadar ciddi aktif enfeksiyon (bkz. Bölüm 4.4).
Bilinen aktif malignite
4.4. Özel kullanım uyarıları ve önlemleri
İzlenebilirlik
Biyoteknolojik tıbbi ürünlerin izlenebilirliğini artırmak üzere, uygulanan ürünün adı ve seri
numarasınet bir şekilde kaydedilmelidir.
Enjeksiyonla ilişkili reaksiyonlar
Hastalar, enjeksiyonla ilişkili reaksiyonların (sistemik) genellikle 24 saat içinde ve özellikle ilk enjeksiyondan sonra meydana gelebileceği konusunda bilgilendirilmelidir (bkz. Bölüm 4.8). RMS klinik çalışmalarında steroidler ile ön ilaç tedavisinin sadece sınırlı faydası olduğu görülmüştür. Enjeksiyonla ilişkili reaksiyonlar, görülmeleri halinde semptomatik tedavi ile kontrol altına alınabilir. Bu nedenle ön ilaç kullanımı gerekmemektedir.
Klinik çalışmalarda gözlenen enjeksiyon bölgesi reaksiyonu (lokal) semptomları eritem, şişlik, kaşıntı ve ağrıyı içermektedir (bkz. Bölüm 4.8).
İlk enjeksiyon uygun eğitim almış bir sağlık uzmanı rehberliğinde yapılmalıdır (bkz. Bölüm 4.2).
Enfeksiyonlar
Tedavinin başlatılmasından önce hastanın bağışıklık durumunun değerlendirilmesi önerilir.
Etki şekli ve mevcut klinik deneyime istinaden, ofatumumab enfeksiyon riskinde artış potansiyeline sahiptir (bkz. Bölüm 4.8).
Uygulama aktif enfeksiyonu olan hastalarda enfeksiyon düzelene kadar ertelenmelidir. Ofatumumab, ağır immün yetmezliği olan hastalara verilmemelidir (örn., ciddi nötropeni veya lenfopeni).
Progresif multifokal lökoensefalopati
Progresif multifokal lökoensefalopati (PML) ile sonuçlanan John Cunningham (JC) virüs enfeksiyonu, anti-CD20 antikorları diğer MS tedavileri ve onkoloji endikasyonlarında önemli ölçüde daha yüksek dozlarda ofatumumab ile tedavi gören hastalarda gözlenmiş olduğundan, hekimler PML tıbbi öyküsüne ve PML'yi düşündürebilecek herhangi bir klinik semptom veya MRG bulgularına karşı tetikte olmalıdır. PML'den şüphe edilirse, PML ekarte edilene kadar ofatumumab ile tedavi askıya alınmalıdır.
Hepatit B virüsü reaktivasyonu
Hepatit B reaktivasyonu anti-CD20 antikorları ile tedavi edilen hastalarda meydana gelmiş, bazı vakalar fulminant hepatit, karaciğer yetmezliği ve ölümle sonuçlanmıştır.
Aktif hepatit B hastalığı olan hastalar ofatumumab ile tedavi edilmemelidir. Tedavi başlatılmadan önce tüm hastalarda HBV taraması gerçekleştirilmelidir. En azından tarama hepatit B yüzey antijeni (HBsAg) ve hepatit B çekirdek antikoru (HBcAb) testini içermelidir. Bunlar lokal kılavuzlara göre diğer uygun belirteçler ile desteklenmelidir. Pozitif hepatit B serolojisine (HBsAg veya HBcAb) sahip hastalar tedaviye başlamadan önce bir karaciğer hastalığı uzmanına danışmalı ve hepatit B reaktivasyonunu önlemek üzere lokal tıbbi standartlar izlenerek takip ve kontrol
edilmelidir.
Ağır immün yetmezliği olan hastaların tedavisi
Ağır immün yetmezliği olan hastalar durumları düzelene kadar tedavi edilmemelidir (bkz. Bölüm
4.3).
Relapsların semptomatik tedavisi için kortikosteroidler haricinde ofatumumab ile eşzamanlı olarakdiğer immünosupresanların kullanılması önerilmez.
Aşılamalar
Tüm bağışıklamalar canlı veya canlı-attenüe aşılar için ofatumumab başlatılmasından en az 4 hafta ve mümkün olduğunda inaktive aşılar için ofatumumab başlatılmasından en az 2 hafta önce bağışıklama kılavuzlarına göre uygulanmalıdır.
Ofatumumab inaktive aşıların etkililiğini bozabilir.
Ofatumumab tedavisini takiben canlı veya canlı-attenüe aşılarla bağışıklamanın güvenliliği araştırılmamıştır. Canlı veya canlı-attenüe aşılarla aşılama tedavi sırasında ve tedavinin bırakılmasının ardından B-hücre seviyesinin normale dönmesine kadar önerilmez (bkz. Bölüm 4.5). Normalin alt sınırına (NAS, 40 hücre/µl olarak tanımlanır) veya başlangıç değerine B hücresi iyileşmesine kadar geçen medyan süre, faz III çalışmalardan elde edilen verilere dayalı olarak tedavinin kesilmesinden sonra 24,6 haftadır (bkz. Bölüm 5.1).
Hamilelik sırasında ofatumumab ile tedavi edilen annelerden doğan bebeklerin aşılanması
Hamilelik sırasında ofatumumab ile tedavi edilen annelerin bebeklerinde, canlı veya canlı- attenüe aşılar B-hücresi sayımlarının düzeldiği doğrulanmadan önce uygulanmamalıdır. Bu bebeklerde Bhücreleri azalması canlı veya canlı-attenüe aşılara bağlı riskleri artırabilir.
İnaktive aşılar B-hücre azalması düzelmesinden önce belirtildiği şekilde uygulanabilir, ancak koruyucu bir bağışıklık yanıtının oluşup oluşmadığını belirlemek üzere kalifiye bir uzmanla konsültasyon dahil aşı bağışıklık yanıtlarına ilişkin bir değerlendirme düşünülmelidir (bkz. Bölüm 4.6). Diğer tüm terapotik proteinlerde olduğu gibi JEMVY için de potansiyel immunojenesite riski söz konusudur.
Yardımcı maddeler
Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında âsodyum
içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Sitokrom P450 enzimleri, diğer metabolizan enzimler veya taşıyıcılar aracılığıyla etkileşim beklenmediğinden etkileşim çalışmaları yürütülmemiştir.
Aşılar
Ofatumumab tedavisi sırasında canlı, calı-attenüe veya inaktive aşılarla bağışıklamaya primer veya anamnestik (bellek) yanıt oluşturma kabiliyeti ve bunun güvenliliği araştırılmamıştır. Aşıya yanıt B hücreleri azaldıgında bozulabilir. Hastaların ofatumumab tedavisine başlamadan önce
bağışıklama programlarını tamamlamaları önerilir (bkz. Bölüm 4.4).
Diğer immünosupresif veya immün düzenleyici tedaviler
İmmünosupresif tedaviler ofatumumab ile birlikte uygulanırken ilave immün sistem etkileri riski dikkate alınmalıdır.
Uzun süreli immün etkileri olan diğer immünosüpresif tedavilerden sonra ofatumumaba başlarken veya ofatumumabdan sonra uzun süreli immün etkileri olan diğer immünosüpresif tedavileri başlatırken, potansiyel ilave immünosupresif etkiler nedeniyle bu tıbbi ürünlerin etki süresi ve etkişekli dikkate alınmalıdır (bkz.Bölüm 5.1).
Özel popülasyonlara ilişkin ek bilgiler:
Etkileşim açısından özel popülasyonlara ilişkin veri bulunmamaktadır.
Pediyatrik popülasyon:
Etkileşim açısından pediyatrik popülasyona ilişkin veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlar, JEMVY kullanırken ve son JEMVY uygulamasının ardından en az 6 ay boyunca etkili doğum kontrolü (%1'den düşük gebelik oranlarına yol açan yöntemler) kullanmalıdır.
Gebelik dönemi
Gebe kadınlarda ofatumumab kullanımına ilişkin sınırlı veri bulunmaktadır. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Ofatumumab, hayvan çalışmalarından bulgulara göre plasentadan geçebilir ve fetal B-hücresi deplesyonuna neden olabilir (bkz. Bölüm 5.3). Gebe maymunlara organogenez sırasında intravenöz ofatumumab uygulamasından sonra teratojenisite gözlenmemiştir.
Gebelik sırasında diğer anti-CD20 antikorlarına maruz kalmış annelerin bebeklerinde geçici periferik B-hücresi azalması ve lenfositopeni bildirilmiştir. İn utero ofatumumaba maruz kalmış bebeklerde B-hücresi azalmasının potansiyel süresi ve B-hücresi azalmasının aşıların güvenliliği ve etkililiği üzerindeki etkisi bilinmemektedir (bkz. Bölüm 4.4 ve 5.1).
Anne için potansiyel fayda fetüs için potansiyel riske ağır basmadığı sürece gebelik sırasında ofatumumab ile tedaviden kaçınılmalıdır.
Laktasyon dönemi
Ofatumumabın insan sütüyle atılıp atılmadığı bilinmemektedir. Ofatumumabın süt ile atılımı
hayvanlar üzerinde araştırılmamıştır. İnsanlarda, IgG antikorlarının sütle atılımı doğumdan
sonraki ilk birkaç gün sırasında görülür ve kısa sürede düşük konsantrasyonlara düşer.
Emzirmenin durdurulup durulmayacağına ya da JEMVY tedavisinin durdurulup durdurulmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve JEMVY tedavisinin emziren anne açısından faydası dikkate alınmalıdır. Sonuç olarak, bu kısa periyot sırasında emzirilen çocuk için risk göz önünde bulundurulmalıdır. Sonrasında, ofatumumab klinik olarak endike ise emzirme sırasında kullanılabilir. Öte yandan hasta gebeliğin son birkaç ayına kadar ofatumumab ile tedavi edilmişse emzirme doğumdan hemen sonra başlatılabilir.
Üreme yeteneği/Fertilite
Ofatumumabın insan fertilitesi üzerindeki etkisine dair veri bulunmamaktadır.
Klinik dışı veriler maymunlarda değerlendirilen erkek ve dişi fertilite parametreleri temelinde
insanlar için potansiyel tehlikelere işaret etmemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
JEMVY'nin araç ve makine kullanımı üzerine bilinen etkisi yoktur veya ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
En önemli ve sık bildirilen advers reaksiyonlar üst solunum yolu enfeksiyonları (%39,4), sistemik enjeksiyonla ilişkili reaksiyonlar (%20,6), enjeksiyon bölgesi reaksiyonları (%10,9) ve idrar yolu enfeksiyonlarıdır (%11,9) (daha fazla detay için bkz. Bölüm 4.4 ve aşağıdaki alt bölüm âSeçili advers olayların tanımıâ).
Advers reaksiyonların tablo halinde listesi
Pivotal RMS klinik çalışmalarında ofatumumab kullanımı ile ilişkili olarak bildirilmiş advers reaksiyonlar Tablo 1'de MedDRA sistem organ sınıfına göre listelenmiştir. Her bir sistem organ sınıfı içinde, advers reaksiyonlar sıklığa göre sıralanmaktadır ve ilk önce en sık görülen reaksiyonlar belirtilmektedir. Her bir sıklık grubunda, advers reaksiyonlar azalan ciddiyet sırasına göre sunulmaktadır. Ek olarak, her advers ilaç reaksiyonu için karşılık gelen sıklık kategorisi, aşağıdaki sisteme dayanmaktadır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1,000 ila <1/100); seyrek (≥1/10,000 ila <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1 Advers reaksiyonların tablo halinde listesi
Enfeksiyonlar ve enfestasyonlar | |
Çok yaygın | Üst solunum yolu enfeksiyonu İdrar yolu enfeksiyonları |
Yaygın | Ağız uçukları |
Genel bozukluklar ve uygulama bölgesi rahatsızlıkları | |
Çok yaygın | Enjeksiyon bölgesi reaksiyonları (lokal) |
Yaralanma, zehirlenme ve prosedür komplikasyonları | |
Çok yaygın | Enjeksiyonla ilişkili reaksiyonlar (sistemik) |
Araştırmalar | |
Çok yaygın | Kan IgM azalması |
bakteriüri. | |
Seçilen advers reaksiyonların tanımı
Enfeksiyonlar
RMS faz III klinik çalışmalarında, ofatumumab ile tedavi edilen hastalarda genel enfeksiyon ve ciddi enfeksiyon oranı, teriflunomid ile tedavi edilen hastalara benzer olmuştur (sırasıyla
%51,6'ya karşı %52,7 ve %2,5'e karşı %1,8). Ciddi bir enfeksiyon nedeniyle iki hasta (%0,2) çalışmada tedaviyi bırakmış ve 11 hasta (%1,2) çalışmada tedaviye geçici olarak ara vermiştir.
Üst solunum yolu enfeksiyonları
Bu çalışmalarda, teriflunomid ile tedavi edilen hastaların %37,8'ine kıyasla ofatumumab ile tedavi edilen hastaların %39,4'ü üst solunum yolu enfeksiyonları yaşamıştır. Enfeksiyonlar baskın olarak hafif ila orta şiddettedir ve çoğunlukla nazofarenjit, üst solunum yolu enfeksiyonu ve influenzadan oluşmuştur.
Enjeksiyonla ilişkili reaksiyonlar
RMS faz III klinik çalışmalarında, enjeksiyonla ilişkili reaksiyonlar (sistemik) ofatumumab ile tedavi edilen hastaların %20,6'sında bildirilmiştir.
Enjeksiyonla ilişkili reaksiyonların insidansı ilk enjeksiyon ile en yüksektir (%14,4) ardışık enjeksiyonlarla anlamlı olarak azalmıştır (ikinci ile %4,4, üçüncü enjeksiyondan itibaren <%3). Enjeksiyonla ilişkili reaksiyonlar çoğunlukla (%99,8) hafif ila orta şiddette görülmüştür. Ofatumumab ile tedavi edilen iki (%0,2) MS hastası ciddi ancak hayati risk taşımayan enjeksiyonla ilişkili reaksiyon bildirmiştir. En sık bildirilen semptomlar (≥%2) ateş, baş ağrısı, kas ağrısı, titreme ve yorgunluğu içermiştir.
Enjeksiyon bölgesi reaksiyonları
RMS faz III klinik çalışmalarında, enjeksiyon bölgesi reaksiyonları (lokal) ofatumumab ile tedavi edilen hastaların %10,9'unda bildirilmiştir.
Uygulama bölgesinde lokal reaksiyonlar çok yaygın görülmüştür. Enjeksiyon bölgesi
reaksiyonlarının tümü hafif ila orta şiddette olup, ciddi değildir. En sık bildirilen semptomlar (≥%2) eritem, ağrı, kaşıntı ve şişliği içermiştir.
Laboratuar anomalileri
İmmünoglobulinler
RMS faz III klinik çalışmalarının seyri sırasında ortalama immünoglobulin M (IgM) değerinde azalma (48 hafta sonra %30,9 ve 96 hafta sonra %38,8 azalma) gözlenmiş ve ciddi enfeksiyonlar da dahil olmak üzere enfeksiyon riski ile ilişki olmadığı gösterilmiştir.
Hastaların %14,3'ünde ofatumumab ile tedavi IgM'de 0,34 g/dl altındaki bir değere erişmiş bir azalma ile sonuçlanmıştır.
Ofatumumab ortalama immünoglobulin G (IgG) düzeylerinde 48 hafta tedaviden sonra %4,3'lük geçici bir azalma ile, ancak 96 haftadan sonra %2,2'lik bir artışla ilişkilendirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
MS'li hastalarla yürütülen klinik çalışmalarda doz kısıtlayıcı toksisite görülmeksizin 700 mg'a varan dozlar uygulanmıştır. Doz aşımı durumunda hastanın advers reaksiyonların belirti veya semptomları açısından izlenmesi ve gerekli şekilde uygun semptomatik tedavinin başlatılması önerilmektedir.
Ofatumumab daha önce infüzyon yoluyla intravenöz olarak uygulanan 2000 mg'a varan dozlarda kronik lenfositik lösemi (KLL) endikasyonlarında kullanılmıştır. Subkutan enjeksiyonla uygulanan ofatumumab değerlendirilmemiştir ve bu endikasyonlar için onaylı değildir ve onkoloji endikasyonlarının tedavisi için kullanılmamalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Seçici immünosupresanlar ATC kodu: L04AA52Etki mekanizması
Ofatumumab tamamen insan bir anti-CD20 monoklonal antikorudur (IgG1). CD20 molekülü pre- B'den olgun B lenfositi aşamasına B lenfositlerinde ekspresyonu yapılan bir transmembran
fosfoproteindir. CD20 molekülü ayrıca aktive T hücrelerinin küçük bir fraksiyonunda eksprese
edilir.
Ofatumumabın CD20'ye bağlanması, başlıca kompleman aracılı sitotoksisite (CDC) ve daha düşük boyutta antikora bağımlı hücre aracılı sitotoksisite (ADCC) aracılığıyla CD20+ B hücrelerinin lizisini indükler. Ofatumumabın aynı zamanda hem yüksek hem de düşük CD20 ekspresyonu yapan hücrelerde hücre lizisini indüklediği gösterilmiştir. CD20-ekspresyonu yapan T hücreleri aynı zamanda ofatumumab ile azaltılır.
Farmakodinamik etkiler
B-hücresi azalması
4 haftada bir 20 mg ofatumumabın kullanıldığı RMS klinik çalışmalarında, 1, 7 ve 14. günlerde 20 mg'lık bir başlangıç doz rejiminden sonra uygulama, tedavinin başlamasından iki hafta sonra gibi kısa bir süre içinde B hücrelerinin NAS'nin (40 hücre/µl olarak tanımlanır) altına hızlı ve sürekli bir şekilde azalmasıyla sonuçlanmıştır. 4. haftada başlayan idame fazı başlatılmadan önce, hastaların %94'ünde <10 hücre/µl toplam B hücresi seviyelerine ulaşılmış olup bu değer
12. haftada hastaların %98'ine yükselmiş ve 120 haftaya kadar sürdürülmüştür (yani çalışma tedavisi sırasında).
B-hücresi seviyesinin normale dönmesi
RMS Faz III klinik çalışmalarından veriler, B-hücresinin LLN veya başlangıç değerine düzelmesine, tedavinin bırakılmasından sonra 24,6 haftalık bir medyan süreyi göstermektedir. PK- B hücresi modelleme ve B-hücresi azalması için simülasyon bu verileri desteklemekte ve B- hücresinde LLN'ye düzelmek için tedavi sonrası 23 haftalık bir medyan süreyi öngörmektedir.
İmmünojenisite
RMS faz III çalışmalarında, tedaviye bağlı anti-ilaç antikorlarının (ADA'lar) genel insidansı ofatumumab ile tedavi edilen hastalarda %0,2 (914'ten 2'si) olmuş ve tedaviyi güçlendiren veya nötralize eden ADA'sı olan hiçbir hasta tanımlanmamıştır. Ofatumumab ile ilişkili ADA insidansı düşük olduğundan, pozitif ADA titrelerinin PK, güvenlilik profili veya B-hücresi kinetiği üzerindeki etkisi değerlendirilemez.
Klinik etkililik ve güvenlilik
JEMVY'nin etkililiği ve güvenliliği, 18 ila 55 yaşında, taramada 0 ile 5.5 arasında Genişletilmiş Özürlülük Durumu Ölçeği (EDSS) skorunda özürlülük durumuna sahip ve önceki yıl sırasında en az bir kanıtlanmış relaps ya da önceki iki yıl sırasında iki relaps veya önceki yıl sırasında pozitif gadolinyum (Gd)-tutan MRG taramasına sahip relapsla seyreden MS'li (RMS) hastalarda yürütülen birebir aynı tasarıma sahip iki randomize, çift kör, aktif kontrollü faz III pivotal çalışmada (Çalışma 1 [ASCLEPIOS I] ve Çalışma 2 [ASCLEPIOS II]) değerlendirilmiştir. Gerek yeni tanı konmuş hastalar gerekse mevcut tedavilerinden geçiş yapan hastalar kaydedilmiştir.
İki çalışmada RSM'li sırasıyla 927 ve 955 hasta 1:1 oranında ilk 14 günde haftada 20 mg'lık üç dozluk (1, 7 ve 14. günlerde) başlangıç dozundan sonra 4. haftadan itibaren her 4 haftada bir ofatumumab 20 mg subkutan enjeksiyonları veya günde bir kez oral teriflunomid 14 mg kapsülleri almaya randomize edilmiştir. Hastalar aynı zamanda körlüğü sağlamak üzere diğer tedavi koluna
tekabül eden eş plasebo almıştır (çift plasebo tasarımı).
Bireysel hastalar için tedavi süresi, çalışma sonu kriterlerinin ne zaman sağlandığına bağlı olarak değişkendir. Her iki çalışmada, medyan tedavi süresi 85 hafta olup, teriflunomid grubundaki hastaların %23,2'sine karşı ofatumumab grubundaki hastaların %33,0'ı 96 haftadan uzun süre tedavi görmüştür.
Demografikler ve başlangıç özellikleri tedavi kolları ve her iki çalışma arasında iyi dengelenmiştir (bkz. Tablo 2). Ortalama yaş 38 olup, ortalama hastalık süresi ilk semptomun başlangıcından itibaren 8,2 yıldır ve ortalama EDSS skoru 2,9'dur; hastaların %40'ı daha önce bir hastalığı modifiye edici tedavi (DMT) ile tedavi görmezken, %40'ı başlangıç MRG taramalarında gadolinyum (Gd)-tutan T1 lezyonları göstermiştir.
Her iki çalışmanın birincil etkililik sonlanım noktası EDSS temelinde doğrulanmış relapsların yıllık oranıdır (ARR). Kritik ikincil etkililik sonlanım noktaları başlangıç EDSS skoru sırasıyla 0, 1 ila 5 veya ≥5,5 olan hastalarda EDSS skorunda ≥1,5, ≥1 veya ≥0,5 artış olarak tanımlanan EDSS'de maluliyet kötüleşmesine kadar geçen süreyi (3. ay ve 6. ayda doğrulanmış) içermiştir. İlave kritik sonlanım noktaları MRG taraması başına Gd-tutan T1 lezyonları sayısını ve yıllık yeni veya genişleyen T2 lezyonları sayısını içermiştir. Özürlülükle ilişkili kritik ikincil sonlanım noktaları çalışma protokollerinde tanımlandığı üzere ASCLEPIOS Çalışma 1 ve Çalışma 2 çalışmalarından birleştirilmiş verilerin meta-analizinde değerlendirilmiştir.
Tablo 2 Demografikler ve başlangıç özellikleri
Özellikler | Çalışma 1 (ASCLEPIOS I) | Çalışma 2 (ASCLEPIOS II) | ||
| Ofatumumab (N=465) | Teriflunomid (N=462) | Ofatumumab (N=481) | Teriflunomid (N=474) |
Yaş (ortalama ± standart sapma; yıl) | 39±9 | 38±9 | 38±9 | 38±9 |
Cinsiyet (kadın; %) | 68,4 | 68,6 | 66,3 | 67,3 |
Tanıdan beri MS süresi (ortalama/medyan; yıl) | 5,77/3,94 | 5,64/3,49 | 5,59/3,15 | 5,48/3,10 |
Daha önce DMT'lerle tedavi edilmiş (%) | 58,9 | 60,6 | 59,5 | 61,8 |
Son 12 aydaki relaps sayısı | 1,2 | 1,3 | 1,3 | 1,3 |
EDSS skoru (ortalama/medyan) | 2,97/3,00 | 2,94/3,00 | 2,90/3,00 | 2,86/2,50 |
Ortalama toplam T2 lezyon hacmi (cm) | 13,2 | 13,1 | 14,3 | 12,0 |
Gd+ T1 lezyonları olan hastalar (%) | 37,4 | 36,6 | 43,9 | 38,6 |
Gd+ T1 lezyonların sayısı (ortalama) | 1,7 | 1,2 | 1,6 | 1,5 |
Her iki çalışma için etkililik bulguları Tablo 3, Şekil 1'de özetlenmektedir.
Her iki Faz III çalışmada, teriflunomide kıyasla ofatumumab yıllık relaps oranında sırasıyla %50,5
ve %58,5'lik anlamlı bir azalma göstermiştir.
Birleştirilmiş verilerde önceden belirtilmiş meta-analiz teriflunomide kıyasla ofatumumabın 3-
aylık doğrulanmış özürlülük progresyonu (CDP) riskini %34,4 ve 6-aylık CDP'yi %32,5 oranında anlamlı olarak azalttığını göstermiştir (bkz. Şekil 1).
Teriflunomide kıyasla ofatumumab Gd-tutan T1 lezyonlarını %95,9 ve yeni veya genişleyen T2 lezyonlarının oranını %83,5 oranında anlamlı olarak azaltmıştır (değerler birleştirilmiş çalışmalar için ortalama azalmaları temsil etmektedir).
İki faz III çalışmada, cinsiyet, yaş, vücut ağırlığı, önceki steroid olmayan MS tedavisi ve başlangıçtaki özürlülük ve hastalık aktivitesi ile tanımlanan keşifsel alt gruplarda teriflunomide kıyasla ofatumumabın kritik etkililik bulguları üzerinde benzer bir etkisi gözlenmiştir.
Tablo 3 RMS'de yürütülen faz III çalışmalardan kritik bulguların genel özeti
Sonlanım Noktaları | Çalışma 1 (ASCLEPIOS I) | Çalışma 2 (ASCLEPIOS II) | ||
Ofatumumab 20 mg (N=465) | Teriflunomid 14 mg (N=462) | Ofatumumab 20 mg (N=481) | Teriflunomid 14 mg (N=474) | |
Ayrı ayrı çalışmalar temelinde sonlanım noktaları | ||||
Yıllık relaps oranı (ARR) (birincil sonlanım noktası) | 0,11 | 0,22 | 0,10 | 0,25 |
Oran azalması | %50,5 (p<0,001) | %58,5 (p<0,001) | ||
MRG taraması başına T1 Gd-tutan lezyonların ortalama sayısı | 0,0115 | 0,4523 | 0,0317 | 0,5141 |
Nispi azalma | %97,5 (p<0,001) | %93,8 (p<0,001) | ||
Yılda yeni veya genişleyen T2 lezyonların sayısı | 0,72 | 4,00 | 0,64 | 4,15 |
Nispi azalma | %81,9 (p<0,001) | %84,5 (p<0,001) | ||
Önceden belirtilmiş meta-analizler temelinde sonlanım noktaları | ||||
3 aylık doğrulanmış özürlülüğe sahip hastaların oranı Risk azalması | %15,0 teriflunomide karşı %10,9 ofatumumab
%34,4 (p=0,002) | |||
6 aylık doğrulanmış özürlülüğe sahip hastaların oranı Risk azalması | %12,0 teriflunomide karşı %8,1 ofatumumab
%32,5 (p=0,012) | |||
Şekil 1 Tedaviye göre ilk 3-aylık CDP'ye kadar geçen süre (ASCLEPIOS Çalışma 1 ve Çalışma
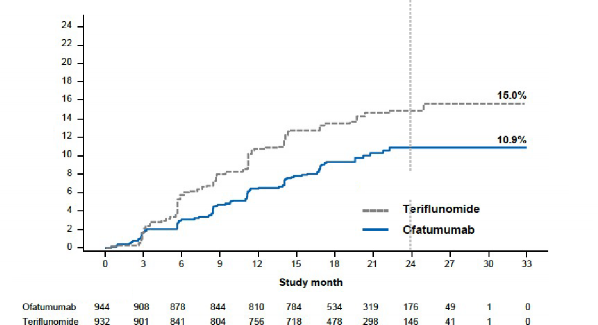
Risk azalması: %34,4, p=0,002
(N=932) (N=944)
2 birlikte, tam analiz seti)
Faz III çalışmalarda, advers olaylar (AE'ler) (%84,2'ye karşı %83,6) ve bırakmaya yol açan AE'lerin (%5,2'ye karşı %5,7) görüldüğü hastaların oranı ofatumumab ve teriflunomid gruplarında benzerdir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
20 mg'lık aylık subkutan doz kararlı durumda 483 µg*s/ml'lik ortalama EEA ve 1,43 µg/ml'lik ortalama C'a yol açar.
Subkutan uygulama sonrasında, ofatumumabın diğer terapötik monoklonal antikorlara benzer şekilde başlıca lenfatik sistem aracılığıyla emildiğine inanılmaktadır.
Dağılım:
Kararlı durumda dağılım hacminin 20 mg dozda tekrarlanan subkutan ofatumumab uygulamasının ardından 5,42 litre olduğu hesaplanmıştır.
Biyotransformasyon:
Ofatumumab beklenen metabolik yolağın yaygın proteolitik enzimler tarafından küçük peptidlere ve amino asitlere parçalanma olduğu bir proteindir.
Eliminasyon:
Ofatumumab iki yolla atılır: B hücrelerine bağlanma ile ilişkili hedef aracılı yol ve spesifik olmayan endositozun ardından diğer IgG molekülleri ile olduğu gibi intraselüler katabolizmanın aracılık ettiği hedeften bağımsız yol. Başlangıçta bulunan B hücreleri tedavinin başında ofatumumab hedef aracılı klirensinin daha büyük bir bileşeni ile sonuçlanır. Ofatumumab ile doz uygulama B hücrelerinin potens azalmasına yol açar ki bu da azalmış genel klirens ile sonuçlanır.
Kararlı durumda yarılanma ömrü 20 mg dozda tekrarlanan subkutan ofatumumab uygulamasının ardından yaklaşık 16 gün olarak hesaplanmıştır.
Doğrusallık/doğrusal olmayan durum:
Ofatumumab zaman içerisinde azalan klirensi nedeniyle doğrusal olmayan bir farmakokinetiğe
sahiptir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda ofatumumabla özel çalışmalar yürütülmemiştir.
Hafif böbrek yetmezliği olan hastalar klinik çalışmalara dahil edilmiştir. Orta şiddette ve şiddetli böbrek yetmezliği olan hastalarda deneyim bulunmamaktadır. Bununla birlikte, ofatumumab idrarla atılmadığından, böbrek yetmezliği olan hastalarda doz modifikasyonunun gerekmesi beklenmemektedir.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda ofatumumabla özel çalışmalar yürütülmemiştir.
Ofatumumab gibi monoklonal antikorların hepatik metabolizması ihmal edilebilir olduğundan, karaciğer yetmezliğinin farmakokinetiğini etkilemesi beklenmemektedir. Bu nedenle karaciğer yetmezliği olan hastalarda doz modifikasyonu gerekmesi beklenmemektedir.
Cinsiyet:
Cinsiyet çapraz çalışma popülasyonu analizinde ofatumumab merkezi dağılım hacmi üzerinde orta düzeyde (%12) bir etki göstermiş olup, kadın hastalarda daha yüksek C ve EEA değerleri gözlenmiştir (bu analizde hastaların %48'i erkek ve %52'si kadındır); bu etkiler klinik açıdan ilgili kabul edilmez ve dozda ayarlama önerilmemektedir.
Vücut ağırlığı:
Çapraz çalışma popülasyon analizinin sonuçlarına dayalı olarak, vücut ağırlığı, RMS gönüllülerinde ofatumumaba maruziyetin ortak değişkeni (Cve AUC) olarak tanımlanmıştır.
Ancak vücut ağırlığı, klinik çalışmalarda değerlendirilen güvenlilik ve etkililik ölçütlerini etkilememiştir; bu nedenle doz ayarlaması gerekli değildir.
Pediatrik popülasyon:
18 yaşın altındaki pediatrik hastalarda ofatumumabın farmakokinetiğini araştırmak için hiçbir çalışma yapılmamıştır.
Geriyatrik popülasyon:
Kısıtlı klinik deneyimden dolayı 55 yaş üzerindeki hastalarda ofatumumaba özel farmakokinetik çalışmalar yoktur (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler güvenlilik farmakolojisi sonlanım noktaları dahil tekrarlanan doz toksisitesine ilişkin geleneksel çalışmalar temelinde insanlar için özel bir tehlike ortaya koymamıştır.
Ofatumumab ile karsinojenisite veya mutajenisite çalışmaları yürütülmemiştir. Bir antikor olarak ofatumumabın DNA ile doğrudan etkileşim göstermesi beklenmemektedir.
Maymunlarda yürütülen embriyo-fetal gelişim (EFD) ve geliştirilmiş pre/post-natal gelişim (ePPND) çalışmaları, gestasyon sırasında intravenöz olarak verilen ofatumumaba maruziyetin maternal toksisite, teratojenisite ve embriyo-fetal ve pre/post-natal gelişim üzerinde advers etkilere neden olmadığını göstermiştir.
Bu çalışmalarda, ofatumumab fetüslerin ve bebeklerin kanında tespit edilmiş olup, plasental transferi ve doğum sonrası ofatumumaba devam eden fetal maruziyeti (monoklonal antikorun uzun yarılanma ömrü) doğrulamaktadır. Gestasyon sırasında ofatumumaba maruziyet maternal hayvanlarda ve fetüslerinde ve bebeklerinde beklenen CD20+ B-hücreleri azalmasının yanında fetüslerde azalmış dalak ağırlığına (histolojik korelat yokluğunda) ve yüksek dozlarda bebeklerde keyhole limpey hemosiyanine (KLH) azalmış humoral immün yanıta yol açmıştır. Bütün bu değişiklikler doğum sonrası 6 aylık periyot sırasında geri dönüşüm göstermiştir. Bebeklerde, terapötik dozdan 160 kat daha yüksek dozlarda (EEA temelinde) erken doğum sonrası mortalite gözlenmiş olup, muhtemelen immün düzenlenmeye bağlı potansiyel enfeksiyonlardan kaynaklanmıştır. ePPND çalışmasının bebeklerinde ofatumumabın farmakolojik aktivitesi ile ilişkili NOAEL, NOAEL'de maternal maruziyet aylık 20 mg'lık terapötik dozda insan maruziyeti ile kıyaslandığında en az 22 katlık EEA bazlı bir güvenlilik sınırına yol açmaktadır.
Özel bir maymun fertilite çalışmasında erkek ve dişi fertilite sonlanım noktaları etkilenmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Arjinin
Sodyum asetat trihidrat
Sodyum klorür Polisorbat 80 Disodyum edetat
Hidroklorik asit (pH ayarlaması için) Enjeksiyonluk su
6.2. Geçimsizlikler
6.2. Geçimsizlikler
6.3. Raf ömrü
24 ay
6.5. Ambalajın niteliği ve içeriği
JEMVY, paslanmaz çelik iğne, bir piston tıpası ve sert iğne koruması ile donanımlı, tek kullanımlık cam enjektör olarak takdim edilir. Enjektör bir piston çubuğu ve iğne emniyet cihazına monte edilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve
âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Enjeksiyon öncesinde, kullanıma hazır enjektör oda sıcaklığına erişmesine izin vermek üzere yaklaşık 15 ila 30 dakika önce buzdolabından çıkarılmalıdır. Kullanıma hazır enjektör, kullanmaya hazır olana kadar orijinal kartonunda tutulmalı ve iğne kapağı enjeksiyon yapılmadan hemen öncesine kadar çıkarılmamalıdır. Kullanım öncesinde, çözelti gözetleme penceresinden bakılarak görsel olarak incelenmelidir. Kullanıma hazır enjeksiyon, sıvı görünür partikül içeriyorsa veya bulanıksa kullanılmamalıdır.
Uygulamaya yönelik kapsamlı açıklamalar kullanma talimatında yer almaktadır.
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 31463.14 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 31463.14 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699074950483 |
| Etkin Madde | Ofatumumab |
| ATC Kodu | L04AA52 |
| Birim Miktar | 20 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Malezya ) ve Beşeri bir ilaçdır. |