JANDARK 5 mg 56 film kaplı tablet Kısa Ürün Bilgisi
{ Tofacitinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
JANDARK 5 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet, 5 mg tofasitinibe eşdeğer 8,078 mg tofasitinib sitrat tuzu içerir.
Yardımcı maddeler
Laktoz monohidrat (inek sütü kaynaklı)â¦62,567 mg
Yardımcı maddeler için 6.1 'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
Beyaz renkli, yuvarlak, bikonveks, çentiksiz, film kaplı tablet
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Romatoid artrit
Bir veya daha fazla anti-TNF ajan tedavisine yeterli cevap alınamayan veya anti-TNF
intoleransı olan orta veya şiddetli aktif romatoid artritli (RA) erişkin hastalarda endikedir.
Diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immun supresiflerle birlikte kullanılması uygun değildir (bkz. Bölüm 4.4 ve 4.5).
Psöriatik artrit
Bir veya daha fazla anti-TNF ajan tedavisine yeterli cevap alınamayan veya anti-TNF intoleransı olan aktif psöriatik artritli (PsA) erişkin hastalarda endikedir.
Diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immun
supresiflerle birlikte kullanılması uygun değildir (bkz. Bölüm 5.1).
4.2. Pozoloji ve uygulama şekli
JANDARK tedavisi, JANDARK'ın endike olduğu durumların teşhis ve tedavisinde deneyimli uzman hekimler tarafından başlatılmalı ve izlenmelidir.
Romatoid artrit ve psöriatik artrit
Yetişkinlerde tavsiye edilen doz, günde iki kez uygulanan 5 mg'dır. Orta ve şiddetli böbrek yetmezliği görülen hastalarda tavsiye edilen doz, günde tek doz 5 mg'dır. Bu doz aşılmamalıdır.
| JANDARK |
Yetişkin hastalarda | Günde 2 kez 5 mg |
Günde 1 kez 5 mg | |
Günde 1 kez 5 mg | |
| Hemodiyaliz uygulanan hastalarda doz, diyaliz günlerinde diyaliz seansından sonra uygulanmalıdır. Diyaliz işleminden önce bir doz alınmışsa, diyaliz sonrası hastalarda ek doz önerilmemektedir. |
Mutlak Lenfosit Sayısı, ALC değeri 500 hücre/mm âten düşük olan hastalarda (tekrar testi doğrulanmış) | Doza devam edilmemelidir. |
Mutlak Nötrofil Sayısı, ANC değeri 500 ile 1000 hücre/mm aralığında olan hastalarda | Doz durdurulmalıdır. ANC değeri >1000 hücre/mm olduğunda günde 2 kez 5 mg olacak şekilde devam edilmelidir. |
ANC değeri 500 hücre/mm'ten düşük olan hastalarda | Doza devam edilmemelidir. |
Hemoglobin Değeri <8,0 g/dL veya önceki değere göre >2 g/dL düşüş görülen hastalarda | Hemoglobin değerleri normalleşene kadar doz durdurulmalıdır. |
Güçlü CYP3A4 inhibitörleri (örn. ketokonazol) alan hastalarda ya da,
Güçlü bir CYP2C19 (örn. flukonazol) inhibitörü/inhibitörleri ile orta düzeyde bir CYP3A4 inhibitörü/inhibitörleri alan hastalarda
Orta ve şiddetli derecede böbrek yetmezliği olan hastalarda, (bkz. Özel popülasyonlara ilişkin ek bilgiler)*
Orta derecede karaciğer yetmezliği olan hastalarda (bkz. Özel popülasyonlara ilişkin ek bilgiler)*
Tablo 1: Romatoid artrit ve psöriatik artrit tedavisi için hastalara tavsiye edilen dozlar
*JANDARK'ın şiddetli karaciğer yetmezliği olan hastalarda kullanımı önerilmemektedir. İdame tedavi
İdame tedavi için önerilen doz günde 2 kere oral yoldan verilen JANDARK 5 mg'dır. JANDARK ile tedaviye cevap veren hastalarda tedavi standardına göre kortikosteroidler azaltılabilir ve/veya kesilebilir.
Doza ara verilmesi veya kesilmesi
Hastada ciddi bir enfeksiyon ortaya çıkması durumunda enfeksiyon kontrol altına alınana
kadar tedaviye ara verilmelidir.
Lenfopeni, nötropeni ve anemi gibi doz ile alakalı laboratuvar anormalliklerinin yönetilmesi için tofasitinib'e ara verilmesi gerekebilir. Laboratuvar anormalliklerinin şiddetine bağlı olarak doza geçici olarak ara verilmesi veya tamamen bırakılması önerilmektedir (bkz. bölüm 4.4).
Uygulama şekli:
JANDARK, oral yoldan yemeklerle birlikte veya tek başına alınabilir.
Yutma güçlüğü çeken hastalar için JANDARK 5 mg tabletler ezilerek ve su ile alınabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği
Böbrek yetmezliği | Kreatinin klirensi | Böbrek yetmezliğinde doz ayarlaması |
Hafif | 50-80 mL/dak | Doz ayarlaması gerekli değildir. |
Orta | 30-49 mL/dak | Normal renal fonksiyon durumunda önerilen dozun günde iki kez 5 mg olduğu durumda, doz günde bir kez 5 mg'a düşürülmelidir. |
Şiddetli (hemodiyalize giren hastaları da kapsamaktadır) | <30 mL/dak | Normal renal fonksiyon durumunda önerilen dozun günde iki kez 5 mg olduğu durumda, doz günde bir kez 5 mg'a düşürülmelidir. Şiddetli böbrek yetmezliği olan hastalar hemodiyaliz sonrasında bile azaltılmış doz olan 5 mg'da kalmalıdır ve doz aldıktan sonra diyaliz yapılması durumunda doz tekrarlanmamalıdır (bkz. bölüm 5.2). |
Böbrek yetmezliği için doz ayarlaması aşağıdaki tabloda verilmiştir. Tablo 2: Böbrek yetmezliği için doz ayarlaması
Karaciğer yetmezliği:
Karaciğer yetmezliği için doz ayarlaması aşağıdaki tabloda verilmiştir.
Tablo 3: Karaciğer yetmezliği için doz ayarlaması
Karaciğer yetmezliği | Sınıflandırma | Karaciğer yetmezliğinde doz ayarlaması |
Hafif | Child Pugh A | Doz ayarlaması gerekli değildir. |
Orta | Child Pugh B | Normal karaciğer fonksiyon durumunda önerilen dozun günde iki kez 5 mg olduğunda, doz günde bir kez 5 mg'a düşürülmelidir (bkz. bölüm 5.2). |
Şiddetli | Child Pugh C | JANDARK şiddetli karaciğer yetmezliğinde kullanılmamalıdır (bkz. bölüm 4.3). |
Pediyatrik popülasyon
Tofasitinibin 0 yaşından 18 yaşa kadar olan çocuklarda güvenliliği ve etkililiği belirlenmemiştir. Bu yaş grubu ile ilgili veri mevcut değildir.
Geriyatrik popülasyon:
65 yaş ve üzeri hastalarda doz ayarlamasına gerek yoktur. 75 yaş ve üzeri hastalarda sınırlı veri vardır.
Romatoid artrit Çalışma I ila V'e dahil edilmiş olan 3.315 hastadan toplam 505 romatoid artrit hastası 65 yaş ve üzerinde, bu hastaların da 71'i 75 ve üzeri yaştadır. Tofasitinib ile tedavi edilen 65 yaş ve üzeri hastalarda gözlenen ciddi enfeksiyon sıklığı, 65 yaş altı hastalarda görülenden daha yüksek olmuştur.
UC programında tofasitinib ile tedavi edilen 1.116 hastanın toplam 77'si (%7) 65 ve üzeri yaştadır. 65 yaş ve üstü hasta sayısı, 65 yaş altı hastalardan farklı yanıt verip vermediklerini belirlemek için yeterli görülmemiştir.
Genel olarak yaşlı popülasyonda enfeksiyon insidansı daha yüksek olduğundan, bu grup hastaların tedavisi sırasında dikkatli olunmalıdır (bkz. Bölüm 4.4).
İlaç etkileşimi
Tofasitinib dozu sitokrom P450 (CYP) 3A4'ün potent inhibitörü (örn. ketokonazol) kullanan hastalarda yarıya düşürülmelidir. Orta derecede CYP3A4 inhibisyonu ve aynı zamanda potent CYP2C19 inhibisyonu yapan (örn. flukonazol) bir veya daha fazla ilacı beraber kullanan hastalarda tofasitinib dozu, günde iki kez 5 mg alanlarda günde bir kez 5 mg'a düşürülmelidir (bkz. bölüm 4.5).
4.3. Kontrendikasyonlar
Etkin madde
Aktif tüberküloz (TB), sepsis veya fırsatçı enfeksiyonlar gibi ciddi enfeksiyonlarda
(bkz. bölüm 4.4).
Ciddi karaciğer yetmezliğinde (bkz. bölüm 4.2).
Hamilelik ve emzirme döneminde (bkz. bölüm 4.6).
4.4. Özel kullanım uyarıları ve önlemleri
65 yaş üstü hastalarda kullanım
65 yaş üstü hastalarda tofasitinib ile artan ciddi enfeksiyonlar, miyokardiyal enfarktüs ve malignite riski göz önüne alındığında tofasitinib bu yaş grubu için sadece uygun tedavi alternatifleri yok ise kullanılmalıdır (detaylı bilgi için bölüm 4.4 ve bölüm 5.1'e bakınız).
Diğer tedaviler ile kombinasyon
Tofasitinib, artmış immünosüpresyon ve enfeksiyon riski olasılığı nedeni ile tümör nekrozu faktörü (TNF) antagonistleri, interlökin (IL)-1R antagonistleri, IL-6R antagonistleri, anti-CD20 monoklonal antikorları, IL-17 antagonistleri, IL-12/IL-23 antagonistleri, anti-integrinler, selektif ko-stimülasyon modülatörleri gibi biyolojikler ve azatiyoprin, 6-merkaptopürin,
siklosporin ve takrolimus gibi potent immünosüpresanlar ile birlikte çalışılmamıştır ve bu ilaçlarla kombine kullanımından kaçınılmalıdır.
Romatoid artrit klinik çalışmalarında, tofasitinibin MTX kombinasyonu ile görülen advers
olayların insidansı tofasitinib monoterapisine kıyasla daha yüksektir.
Tofasitinibin fosfodiesteraz 4 inhibitörleri ile kombinasyon halinde kullanımı klinik olarak çalışılmamıştır.
Venöz tromboembolizm (VTE)
Tofasitinib kullanan hastalarda pulmoner emboli (PE) ve derin damar trombozunun (DVT) da dahil olduğu ve bazılarının ölümle sonuçlandığı ciddi VTE olayları görülmüştür. TNF inhibitörleri ile karşılaştırıldığında tofasitinib ile yapılan randomize, ruhsatlandırma sonrası güvenlilik çalışmasında en az bir ek kardiyovasküler risk faktörü olan 50 yaş ve üzeri romatoid artritli hastalarda VTE riskinde doza bağlı artış gözlemlenmiştir (bkz. bölüm 4.8 ve 5.1).
Bu çalışmadaki bir araştırma sonrası analizinde bilinen VTE risk faktörü olan hastalarda sonraki VTE'nin ortaya çıkması tofasitinib ile tedavi edilen hastalarda daha sık görülmüştür (12 aylık tedavide D-dimer düzeyi <2 x ULN olanlara karşı D-dimer düzeyi ≥2 x ULN olanlar). Bu durum TNF inhibitörü ile tedavi edilen hastalarda kanıtlanmış değildir. Kısıtlı D-dimer testi varlığı (yalnızca başlangıçta, 12. ayda ve son çalışmada değerlendirilmiştir) ve az sayıdaki VTE olayları nedeniyle sınırlı yorum yapılabilmektedir. Çalışma sırasında, VTE'si olmayan hastalarda ortalama D-dimer düzeyi 12. ayda tüm tedavi kollarında başlangıç düzeyine göre önemli ölçüde azalmıştır. Bununla birlikte, 12. ayda yaklaşık %30 hastada sonradan VTE olayları olmaksızın D-dimer düzeyi ≥2 x ULN olarak gözlenmiştir. Bu durum bu çalışmadaki D-Dimer testinin duyarlılığının sınırlı olduğunu göstermektedir.
Tofasitinib endikasyon ve dozdan bağımsız olarak bilinen VTE riski olan hastalarda dikkatli kullanılmalıdır.
VTE risk faktörleri; daha önce var olan VTE, majör bir ameliyat geçiren hastalar, immobilizasyon, miyokardiyal enfarktüsü (geçmiş 3 ay içinde), kalp yetmezliği, kombine hormonal kontraseptif veya hormon replasman tedavisi kullanılması, kalıtımsal koagülasyon bozukluğu, malignite olup ek VTE risk faktörleri olarak yaş, obezite (BMI≥ 30), diyabet, hipertansiyon, sigara içme durumu göz önünde bulundurulmalıdır. VTE riskindeki değişiklikler açısından tofasitinib kullanan hastalar periyodik olarak tekrar değerlendirilmelidir.
VTE için bilinen risk faktörleri olan RA'lı hastalar için tedavinin yaklaşık 12. ayında D-dimer düzeylerini test etmek düşünülmelidir. Eğer D-dimer test düzeyi ≥2 x ULN ise, tofasitinib ile tedaviye devam etme kararından önce klinik yararların risklere ağır bastığını onaylayınız.
Endikasyon ve dozdan bağımsız olarak VTE belirti ve bulguları olan hastalar hemen değerlendirilmeli ve VTE'den şüphelenildiği durumda tofasitinibe devam edilmemelidir.
Ciddi enfeksiyonlar
Tofasitinib tedavisi alan hastalarda bakteriyel, mikobakteriyel, invazif fungal, viral ya da diğer
fırsatçı patojenlere bağlı ciddi ve bazı durumlarda fatal enfeksiyonlar bildirilmiştir. Fırsatçı enfeksiyon riski Asya coğrafyasında daha yüksektir (bkz. bölüm 4.8). Kortikosteroid kullanan RA hastaları enfeksiyona yatkınlık gösterebilir.
Tofasitinib, lokal enfeksiyonlar da dahil olmak üzere aktif enfeksiyonu olan hastalara
başlanmamalıdır.
Aşağıdaki durumlarda tofasitinibe başlamadan önce tedavinin hastalar açısından faydaları ve riskleri göz önünde bulundurulmalıdır.
Tekrarlayıcı enfeksiyonları olan hastalar,
Ciddi ya da fırsatçı enfeksiyon geçmişi olan hastalar,
Endemik mikoz bulunan yerlerde yaşamış ya da buralara seyahat etmiş olan hastalar,
Enfeksiyona yatkınlığa neden olabilecek altta yatan koşulları bulunan hastalar,
Tofasitinib ile tedavi sırasında ya da tedaviden sonra hastalar enfeksiyon belirtileri ve semptomları açısından yakından izlenmelidir. Hastada ciddi bir enfeksiyon, fırsatçı enfeksiyon ya da sepsis ortaya çıkması halinde ilaca ara verilmelidir. Tofasitinib tedavisi sırasında yeni bir enfeksiyon görülen bir hastaya, immünitesi zayıflamış bir hasta için gerekli, tanısal testler derhal ve eksiksiz olarak yapılmalı, uygun antimikrobiyal tedavi başlamalı ve hasta yakından izlenmelidir.
Genel olarak yaşlı ve diyabeti olan popülasyonda enfeksiyon sıklığı daha yüksek olduğundan, bu gruptaki hastaların tedavisi sırasında dikkatli olunmalıdır (bkz. bölüm 4.8). 65 yaş üstü hastalarda tofasitinib sadece başka uygun tedavi alternatifleri yok ise kullanılmalıdır (bkz. bölüm 5.1).
Lenfopeni derecesindeki artış ile enfeksiyon riski daha yüksek olabilir. Bireysel hasta enfeksiyon riskini değerlendirirken lenfosit sayısına dikkat edilmelidir. Tedavinin durdurulması ve lenfopeni için izlenme kriterleri bölüm 4.2'de belirtilmiştir.
Tüberküloz
Tofasitinib tedavisinden önce hastalar risk ve yarar açısından değerlendirilmelidir:
TB'ye maruz kalmış hastalar,
Endemik TB bulunan yerlerde yaşamış ya da buralara seyahat etmiş olan hastalar.
Tofasitinib tedavisinden önce ve tedavi süresince periyodik olarak hastalar latent ya da aktif
enfeksiyon açısından değerlendirilmeli ve tetkik edilmelidir.
Latent TB enfeksiyonu testi pozitif çıkan hastalar tofasitinib uygulaması öncesi standart bir
antimikobakteriyel ajan ile tedavi edilmelidir.
Yeterli tedavi almış olduğu doğrulanamayan, TB testi negatif latent ya da aktif TB geçmişi olan hastalarda veya testi negatif olduğu halde TB enfeksiyonu açısından risk faktörleri bulunan hastalar için tofasitinib tedavisinden önce anti-tüberküloz tedavi gerekliliği değerlendirilmelidir. TB tedavisinde deneyimli bir uzman tarafından yapılan konsültasyon ile hastaların anti-tüberküloz tedavisi için uygunluk kararının verilmesi önerilmektedir. Tedaviye
başlamadan önce latent TB enfeksiyonu testi negatif çıkan hastalar da dahil olmak üzere hastalar TB belirtileri ve semptomlarının gelişimi açısından yakından izlenmelidir.
Viral reaktivasyon
Tofasitinib ile yapılan klinik çalışmalarda viral reaktivasyon ve herpes virüs reaktivasyonu (örneğin herpes zoster) gözlenmiştir. Tofasitinib ile tedavi edilen aşağıdaki hasta gruplarında herpes zoster görülme insidansında artış görülmüştür:
Japon ve Koreli hastalarda,
ALC 1,000 hücre/mm3'den az olan hastalarda (bkz. bölüm 4.2),
Daha önceden 2 veya daha fazla biyolojik DMARD alan uzun süreli RA hastalarında,
Günde 2 kere 10 mg kullanan hastalarda,
Tofasitinibin kronik viral hepatit reaktivasyonu üzerindeki etkisi bilinmemektedir. Tarama sırasında Hepatit B ya da C için pozitif sonuç veren hastalar, klinik çalışmalardan çıkarılmıştır. Tofasitinib ile tedaviye başlanmadan önce klinik kılavuzlar doğrultusunda viral hepatit için tarama yapılmalıdır.
Major advers kardiyovasküler olaylar (miyokardiyal enfarktüsü dahil)
Tofasitinib alan hastalarda majör advers kardiyovasküler olaylar (MAKO) gözlenmiştir.
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan randomize ruhsat onayı sonrası güvenlilik çalışmasında, TNF inhibitörü alan hastalara kıyasla tofasitinib kullananlarda miyokardiyal enfarktüsü insidansında artış olduğu gözlenmiştir (bkz. bölüm 4.8 ve 5.1). Tofasitinib 65 yaş üstü hastalarda, geçmişte ya da halen sigara içen hastalarda, başka kardiyovasküler risk faktörleri taşıyan hastalarda uygun başka alternatif tedavi seçeneği yoksa kullanılmalıdır.
Malignite ve lenfoproliferatif hastalık
Tofasitinib, malignitelere karşı hastanın savunma sistemini etkileyebilir.
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan randomize ruhsat onayı sonrası güvenlilik çalışmasında, TNF inhibitörü alan hastalara kıyasla tofasitinib kullananlarda malignite (melanom dışı deri kanserleri hariç) özellikle akciğer kanseri ve lenfomaların insidansında artış göstermiştir (bkz. bölüm 4.8 ve 5.1).
Tofasitinib ile tedavi edilen hastalarda akciğer kanseri ve lenfoma diğer klinik çalışmalarda ve pazarlama sonrası araştırmalarda gözlenmiştir.
Tofasitinib ile tedavi edilen hastalarda meme kanseri, melanom, prostat kanseri ve pankreas kanseri dahil fakat bunlarla sınırlı olmamak üzere klinik çalışmalarda ve pazarlama sonrası araştırmalarda diğer maligniteler gözlenmiştir.
Tofasitinib 65 yaş üstü hastalarda, geçmişte ya da halen sigara içen hastalarda, başka malignite risk faktörleri (örneğin, mevcut malignite veya tedavisi başarıyla sonuçlanmış melanom dışı cilt kanseri dışında malignite öyküsü) taşıyan hastalarda başka uygun tedavi alternatifleri yok ise kullanılmalıdır.
Melanom dışı cilt kanseri
Tofasitinib ile tedavi edilen hastalarda NMSC'ler rapor edilmiştir. Cilt kanseri için artmış risk taşıyan hastalar için periyodik cilt muayenesi önerilmektedir (bkz. bölüm 4.8).
İnterstisyel akciğer hastalığı
Kronik akciğer hastalığı hikayesi olan hastalarda enfeksiyona daha yatkın olmaları nedeniyle dikkatli olunması önerilir. RA klinik çalışmalarında ve pazarlama sonrası araştırmalarda tofasitinib ile tedavi gören hastalarda interstisyel akciğer hastalığı olayları (bazılarının ölümcül sonuçları olmuştur) bildirilmiştir. Bu olaylarda Janus kinaz (JAK) inhibisyonunun etkisi bilinmemektedir. Asyalı RA hastalarının interstisyel akciğer hastalığı riskinin daha yüksek olduğu bilinmektedir. Bu sebeple bu hastaların tedavisi sırasında dikkatli olunmalıdır.
Gastrointestinal perforasyon
Tofasitinib ile yürütülen klinik çalışmalarda gastrointestinal perforasyon olguları rapor edilmiştir ancak bu olaylarda JAK inhibisyonunun rolü bilinmemektedir. Gastrointestinal perforasyon riski artmış olan (örneğin divertikülit geçmişi, kortikosteroidler ve/veya non steroidal antiinflamatuvar ilaçlarla birlikte kullanım) hastalarda tofasitinib dikkatli bir şekilde kullanılmalıdır. Yeni başlayan abdominal belirti ve bulgular ile hastaneye başvuran hastalar, gastrointestinal perforasyonunun erken tanısı için derhal değerlendirilmelidir.
Kemik kırıkları
Tofasitinib ile tedavi edilen hastalarda kemik kırıkları gözlenmiştir.
Tofasitinib, yaşlı hastalar, kadın hastalar ve kortikosteroid kullanan hastalar gibi kemik kırığı için bilinen risk faktörleri olan hastalarda endikasyon ve dozajdan bağımsız olarak dikkatli kullanılmalıdır.
Karaciğer enzimleri
Tofasitinib ile tedavi bazı hastalarda karaciğer enzimlerinde yükselme insidansında artış ile ilişkilendirilmiştir (bkz. bölüm 4.8 karaciğer enzim testleri). Bu sebeple alanin aminotransferaz (ALT) veya aspartat aminotransferaz (AST) değerleri yüksek olan hastalarda özellikle potansiyel hepatotoksik bir ajan olan MTX ile birlikte tofasitinib tedavisine başlanması düşünülüyorsa dikkatli olunmalıdır. Başlangıcı takiben potansiyel ilaca bağlı karaciğer hasarı olgularını belirleyebilmek için karaciğer testleri rutin olarak takip edilmeli ve karaciğer enzimlerindeki yükselmenin sebepleri hızlıca araştırılmalıdır. Eğer ilaca bağlı karaciğer hasarından şüphelenilirse, bu teşhis ortadan kalkana kadar tofasitinib tedavisine ara verilmelidir.
Hipersensitivite
Pazarlama sonrası deneyimlerde tofasitinib kullanımı ile ilgili hipersensitivite olguları raporlanmıştır. Anjiyoödem ve ürtiker dahil ciddi alerjik reaksiyonlar görülmüştür. Herhangi bir ciddi alerjik veya anaflaktik reaksiyonun görülmesi durumunda tofasitinib tedavisi derhal kesilmelidir.
Laboratuvar parametreleri Lenfositler
Tofasitinib tedavisi, plasebo ile karşılaştırıldığında artmış lenfopeni insidansı ile ilişkilendirilmiştir. ALC değerinin 750 hücre/mm'ün altına inmesi, ciddi enfeksiyon insidansında artış ile ilişkilendirilmiştir. ALC değerinin 750 hücre/mm'ten daha düşük olduğu doğrulanan hastalarda tofasitinib tedavisine başlanması veya devam edilmesi önerilmemektedir. ALC seviyesi başlangıçta ve ardından her 3 ayda bir izlenmelidir. Lensofit sayısı baz alınarak önerilen düzenlemeler için bölüm 4.2'ye bakınız.
Nötrofiller
Tofasitinib tedavisi, plasebo ile karşılaştırıldığında artmış nötropeni (<2,000 hücre/mm) insidansı ile ilişkilendirilmiştir. ANC değerinin 1,000 hücre/mm'ten daha düşük olan hastalarda tofasitinib tedavisine başlanması önerilmemektedir. Tedavi başlangıcında, 4-8 hafta sonra ve ardından her 3 ayda bir ANC izlenmelidir. ANC baz alınarak önerilen düzenlemeler için bölüm 4.2'ye bakınız.
Hemoglobin
Tofasitinib tedavisi hemoglobin seviyesinde düşüş ile ilişkilendirilmiştir. Hemoglobin değeri 9 g/dL'nin altında olan hastalarda tofasitinib tedavisine başlanması önerilmemektedir. Hemoglobin seviyesi; başlangıçta, tedavi başlangıcından 4-8 hafta sonra ve ardından her 3 ayda bir izlenmelidir. Hemoglobin seviyesi baz alınarak önerilen düzenlemeler için bölüm 4.2'ye bakınız.
Lipid değerlerinin izlenmesi
Tofasitinib tedavisi; total kolesterol, düşük yoğunluklu lipoprotein (LDL) kolesterol ve yüksek yoğunluklu lipoprotein (HDL) kolesterol gibi lipid parametrelerindeki artışlar ile ilişkilendirilmiştir. Maksimum etkiler genellikle 6 hafta içinde gözlenmiştir. Lipid parametrelerinin değerlendirilmesi tofasitinib ile tedavinin başlamasından 8 hafta sonra gerçekleştirilmelidir. Hastalar, hiperlipidemi tedavisine yönelik klinik kılavuzlara göre tedavi edilmelidir. Tofasitinib ile ilişkilendirilen total ve LDL kolesterolü artışları, statin tedavisi ile tedavi öncesi seviyelere düşürülebilmektedir.
Aşılamalar
Tofasitinib tedavisine başlamadan tüm hastaların aşılarının güncel bağışıklama kılavuzlarına uygun olarak tamamlanması tavsiye edilmektedir. Canlı aşıların, tofasitinib ile birlikte uygulanması tavsiye edilmemektedir. Tofasitinib tedavisinden önce canlı aşı kullanım kararında hastanın önceden var olan immünosüpresyonu göz önünde tutulmalıdır.
Profilaktik zoster aşısı, aşılama kılavuzlarına uygun olarak düşünülmelidir. Uzun süredir RA'sı olan ve daha önce iki veya daha fazla biyolojik DMARD almış hastalara özel dikkat gösterilmelidir. Canlı zoster aşısı uygulanıyorsa, yalnızca bilinen suçiçeği öyküsü olan veya varisella zoster virüsü (VZV) için seropozitif olan hastalara yapılmalıdır. Suçiçeği öyküsü şüpheli veya güvenilmez olarak kabul edilirse, VZV'ye karşı antikor testi yapılması önerilir.
Canlı aşı ile aşılama tofasitinib tedavisinin başlamasından en az 2 hafta ancak tercihen 4 hafta öncesinde veya immünomodülatör tıbbi ürünler için geçerli güncel aşılama kılavuzları uyarınca yapılmalıdır. Tofasitinib tedavisi alan hastalarda, canlı aşılar yoluyla enfeksiyonların sekonder olarak aktarımı konusunda veri bulunmamaktadır.
Bu tıbbi ürün, her tablette 62,567 mg laktoz monohidrat içerir. Nadir kalıtımsal galaktoz intoleransı, total laktoz eksikliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer ilaçların JANDARK'ın farmakokinetiğini (PK) etkileme potansiyelleri
Tofasitinib, CYP3A4 ile metabolize edildiğinden, CYP3A4'ü inhibe eden ya da indükleyen ilaçlar ile etkileşimi olabilir. Tofasitinib maruziyeti, potent CYP3A4 inhibitörleri (ketokonazol) ya da orta derecede CYP3A4 ve potent CYP2C19 (örn. flukonazol) inhibisyonuna sebep olan bir veya birkaç ilacın beraber kullanılması ile artar (bkz. bölüm 4.2).
Tofasitinib maruziyeti potent CYP indükleyicileri (örn. rifampin) ile birlikte uygulandığında azalmaktadır. Tek başına CYP2C19 ya da P-glikoprotein inhibitörlerinin JANDARK farmakokinetiğini belirgin bir şekilde değiştirmesi beklenmez.
Ketokonazol (güçlü bir CYP3A4 inhibitörü), flukonazol (orta derecede bir CYP3A4 ve potent CYP2C19 inhibitörü), takrolimus (hafif CYP3A4 inhibitörü) ve siklosporin (orta derecede bir CYP3A4 inhibitörü) ile birlikte kullanımı tofasitinib EAA'sını arttırırken rifampisin (potent CYP indükleyicisi) tofasitinib EAA'sını düşürmektedir. Tofasitinibin potent CYP indükleyicileri (örn. rifampisin) ile birlikte kullanılması klinik cevapalınamamasına veya klinik cevabın azalmasına sebep olabilir (bkz. şekil 1). Tofasitinibin potent CYP3A4 indükleyicileri ile birlikte kullanılması önerilmemektedir. Ketokonazol ve flukonazol ile birlikte kullanılması tofasitinibin Cdeğerini arttırırken takrolimus, siklosporin ve rifampisin ile birlikte kullanılması tofasitinibin Cdeğerini azaltmaktadır. RA hastalarında MTX ile eşzamanlı olarak uygulamanın (haftada bir kez 15-25 mg MTX), tofasitinib farmakokinetiği üzerinde bir etkisi olmamıştır (bkz. Şekil 1).
Şekil 1. Diğer ilaçların tofasitinib farmakokinetiği (PK) üzerine etkisi
Birlikte kullanıldığı PK

CYP3A İnhibitörü
Ketokonazol
CYP3A & CYP2C19
İnhibitörü Flukonazol CYP İndükatör Rifampisin
EAA
CEAA
CEAA
C
Metotreksat Takrolimus
Siklosporin
EAA
CEAA
CEAA
C
ilaçlar
![]()
![]()
Oran ve %90 GA Öneri
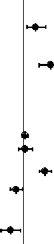
![]()
JANDARK dozu

JANDARK dozu
düşürülmelidir
Etkililiği düşürebilir
düşürülmelidir
![]()
Doz ayarlamasına gerek yok
JANDARK'ın Takrolimus ile kullanımından kaçınılmalıdır
![]()
JANDARK'ın Siklosporin ile
![]()
kullanımından kaçınılmalıdır
Referansa bağıl oran
Not: Referans gruba tofasitinib tek başına uygulanmıştır.
Tofasitinibin diğer ilaçların PK'larını etkileme potansiyeli
Sağlıklı kadın gönüllülerde tofasitinibin birlikte uygulandığı oral kontraseptiflerin levonorgestrel ve etinil estradiol farmakokinetiği üzerinde bir etkisi olmamıştır.
RA hastalarında tofasitinibin haftada bir kez 15-25 mg MTX ile birlikte uygulanması, MTX EAA ve Cdeğerlerini sırasıyla %10 ve %13 oranında düşürmüştür. MTX maruziyetindeki düşüş miktarı, bireysel MTX dozunda ayarlama yapılmasını gerektirmemektedir.
Özel popülasyonlara ilişkin ek bilgiler
Pediyatrik popülasyon:
Etkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
Çocuk doğurma potansiyeli bulunan kadınlara tofasitinib tedavisi sırasında ve son dozdan 4 hafta sonrasına kadar etkili doğum kontrol yöntemleri kullanmaları önerilmelidir.
Gebelik dönemi:
Tofasitinibin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). Tofasitinibin sıçanlarda ve tavşanlarda teratojenik olduğu ve doğum ile doğum sonrası gelişimi etkilediği gösterilmiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Önlem olarak tofasitinib gebelik döneminde kontrendikedir (bkz. bölüm 4.3).
Laktasyon dönemi
Tofasitinibin insan sütüyle atılıp atılmadığı bilinmemektedir. Fakat emzirilen bebeğe zararlı olabilme riski göz ardı edilemez. Tofasitinib emziren sıçanlarda süte geçmiştir (bkz. bölüm 5.3). Önlem olarak tofasitinib kullanımı laktasyon döneminde kontrendikedir (bkz. bölüm 4.3).
Üreme yeteneği/Fertilite
Tofasitinibin insan üremesi üzerine etkisini belirlemek için bir çalışma yapılmamıştır. Tofasitinib dişi sıçanların fertilitesini bozarken erkek sıçanların fertilitesi üzerine etkisi yoktur (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Tofasitinibin araç ve makine kullanma yeteneği üzerine etkisi yoktur veya ihmal edilebilir
düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Romatoid artrit
En yaygın görülen ciddi advers reaksiyonlar, ciddi enfeksiyonlar olmuştur (bkz. bölüm 4.4). Tüm maruziyet popülasyonunda uzun dönem güvenlilik verilerine göre tofasitinib kullanımı ile en yaygın bildirilen ciddi enfeksiyonlar pnömoni (%1,7), herpes zoster (%0,6), idrar yolu enfeksiyonları (%0,4), selülit (%0,4), divertikülit (%0,3), apandisittir (%0,2). Fırsatçı enfeksiyonlar arasından TB ve diğer mikobakteriyel enfeksiyonlar, kriptokok, histoplasmoz, özofageal kandidiyaz, multidermatomal herpes zoster, sitomegalovirüs, BK virüsü enfeksiyonları ve listeriyoz tofasitinib kullanımı ile bildirilmiştir. Bazı hastalar, lokalize yerine yayılmış enfeksiyon bulguları ile başvurmuştur. Klinik çalışmalarda bildirilmeyen diğer ciddi enfeksiyonlar da ortaya çıkabilir (örn. koksidiyoidomikoz).
Çift kör, plasebo veya MTX kontrollü klinik çalışmaların ilk 3 ayında en yaygın rapor edilen advers reaksiyonlar; baş ağrısı (%3,9), üst solunum yolu enfeksiyonları (%3,8), viral üst solunum yolu enfeksiyonları (%3,3), diyare (%2,9), mide bulantısı (%2,7) ve hipertansiyon (%2,2) olmuştur.
Çift-kör, plasebo veya MTX kontrollü çalışmaların ilk 3 ayında herhangi bir advers reaksiyona bağlı olarak tedaviyi bırakma oranı tofasitinib alan hastalar için %3,8'dir. Kontrollü klinik çalışmaların ilk 3 ayında tedavinin bırakılması ile sonuçlanan en yaygın enfeksiyonlar, herpes zoster (%0,19) ve pnömonidir (%0,15).
Psöriatik Artrit
Genel olarak, JANDARK ile tedavi edilen aktif PsA hastalarında gözlenen güvenlilik profili
JANDARK ile tedavi edilen RA hastalarında gözlenen güvenlilik profili ile uyumludur.
RA ve PsA hastalarında yapılan klinik çalışmalara göre advers ilaç reaksiyonları, sistem/organ sınıfı ve aşağıda belirtilen sisteme göre belirlenmiş sıklık kategorisine göre sınıflandırılmıştır; çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık grubunda, istenmeyen etkiler azalan ciddiyet sırasına göre yer almaktadır.
Enfeksiyonlar ve enfestasyonlar
Yaygın: İdrar yolları enfeksiyonu, bronşit, herpes zoster, influenza, sinüzit, farenjit, pnömoni,
nazofarenjit
Yaygın olmayan: Herpes simpleks, viral enfeksiyon, viral gastroenterit, selülit, piyelonefrit, divertikülit, tüberküloz
Seyrek: Ürosepsis, sitomegalovirus enfeksiyonu, ensefalit, nekrotizan fasiit, dissemine tüberküloz, Pnömosistis jiroveci pnömonisi, stafilokokal bakteremi, atipik mikobakteriyel enfeksiyon, bakteriyemi, sepsis, bakteriyel artrit, bakteriyel pnömoni, pnömokokal pnömoni Çok seyrek: Merkezi sinir sistemi tüberkülozu, menenjit kriptokokal nekrotizan fasiit, ensefalit, stafilokokal bakteriyemi, micobacterium avium kompleks enfeksiyonu, atipik mikobakteriyel enfeksiyon
(Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalar
Yaygın olmayan: Akciğer kanseri, melanom dışı cilt kanseri
Seyrek: Lenfoma
Kan ve lenf sistemi hastalıkları
Yaygın: Lenfopeni, anemi
Yaygın olmayan: Nötropeni, lökopeni
Bağışıklık sistemi hastalıkları
Bilinmiyor: İlaca aşırı duyarlılık*, anjiyoödem*, ürtiker*
Metabolizma ve beslenme hastalıkları
Yaygın olmayan: Dehidratasyon, hiperlipidemi, dislipidemi
Psikiyatrik hastalıklar
Yaygın olmayan: İnsomnia
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Yaygın olmayan: Parestezi
Kardiyak hastalıklar:
Yaygın olmayan: Miyokardiyal enfarktüsü
Vasküler hastalıklar:
Yaygın: Hipertansiyon
Yaygın olmayan: Venöz tromboemboli**
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Öksürük
Yaygın olmayan: Sinüs konjesyonu, dispne
Gastrointestinal hastalıklar
Yaygın: Diyare, bulantı, dispepsi, gastrit, kusma, abdominal ağrı
Hepato-biliyer hastalıklar
Yaygın olmayan: Hepatik steatoz, hepatik enzim artışı, transaminaz artışı, gama- glutamiltransferaz artışı
Seyrek: Anormal karaciğer test sonuçları
Deri ve deri altı doku hastalıkları
Yaygın: Döküntü
Yaygın olmayan: Pruritus, eritem
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Artralji
Yaygın olmayan: Tendinit, eklem şişliği
Seyrek: Muskuloskeletal ağrı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Periferik ödem
Yaygın olmayan: Pireksi, yorgunluk
Araştırmalar
Yaygın: Kan kreatin fosfokinaz düzeyi artışı
Yaygın olmayan: Kan kreatinin artışı, kan kolesterol düzeyi artışı, düşük yoğunluklu lipoprotein artışı, kilo artışı
Yaralanma ve zehirlenme
Yaygın olmayan: Ligamentte burkulma, kas gerilmesi
*Spontan raporlanan veri
** Venöz tromboemboli PE ve DVT'yi içerir.
Seçilmiş yan etkilerin açıklanması
Venöz tromboemboli
Romatoid artrit
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş, randomize, onay sonrası güvenlilik denetleme çalışmasında, TNF inhibitörlerine kıyasla tofasitinib ile tedavi edilen hastalarda doza bağımlı olarak artan insidansta VTE gözlenmiştir. Bu olayların çoğu ciddidir ve bazıları ölümle sonuçlanmıştır. Güvenlilik ara analizinde, günde iki kez 10 mg tofasitinib, günde iki kez 5 mg tofasitinib ve TNF inhibitörleri için PE insidans oranları (%95 GA) her 100 hasta yıl için sırasıyla 0,54 (0,32- 0,87), 0,27 (0,12-0,52) ve 0,09 (0,02-0,26)'dur. TNF inhibitörleri ile karşılaştırıldığında PE risk oranı (HR), günde iki kez 10 mg tofatinib ve günde iki kez 5 mg tofasitinib için sırasıyla 5,96 (1,75-20,33) ve 2,99 (0,81-11,06)'dur (bkz. bölüm 5.1).
Yukarıda bahsedilen çalışmanın ara analizinde VTE risk faktörü görülen hastalarda yapılan bir alt grup analizinde, PE riski daha da yükselmiştir. TNF inhibitörleri ile karşılaştırıldında PE için HR, günde iki kez 10 mg tofasitinib için 9,14 (2,11-39,56) ve günde iki kez 5 mg tofasitinib için 3,92'dir (0,83-18,48).
Genel enfeksiyonlar
Romatoid artrit
0-3 ay boyunca, kontrollü Faz 3 klinik çalışmalarında, günde iki kez 5 mg (toplam 616 hasta) ve günde iki kez 10 mg (toplam 642 hasta) tofasitinib monoterapi gruplarındaki enfeksiyon oranları sırasıyla %16,2 (100 hasta) ve %17,9 (115 hasta) iken, plasebo grubunda (toplam 122 hasta) bu oran %18,9 (23 hasta) olmuştur. DMARD kombinasyon tedavisi içeren kontrollü Faz 3 klinik çalışmalarında, günde iki kez 5 mg (toplam 973 hasta) ve günde iki kez 10 mg (toplam 969 hasta) tofasitinib artı DMARD gruplarındaki ilk 3 aydaki enfeksiyon oranları, sırasıyla
%21,3 (207 hasta) ve %21,8 (211 hasta) iken plasebo artı DMARD grubunda (toplam 559 hasta)
bu oran %18,4 (103 hasta) olmuştur.
En yaygın rapor edilen enfeksiyonlar, üst solunum yolu enfeksiyonu ve nazofarenjit olmuştur (sırasıyla %3,7 ve %3,2).
Uzun süreli tüm güvenlilik maruziyet popülasyonunda (toplam 4,867 hasta) tofasitinib ile genel enfeksiyon oranı, 100 hasta yılı başına 46,1 olay olmuştur (günde iki kez 5 mg ve 10 mg için sırasıyla 43,8 ve 47,2 hasta). Monoterapi alan hastalar için (toplam 1,750) oran 100 hasta yılı başına günde iki kez 5 mg ve 10 mg için sırasıyla 48,9 ve 41,9 olaydır. DMARD'lar ile kombinasyon tedavisi alan hastalar için (toplam 3,117), enfeksiyon oranları 100 hasta yılı başına günde iki kez 5 mg ve 10 mg için sırasıyla 41,0 ve 50,3 olay olarak gerçekleşmiştir.
Ciddi enfeksiyonlar
Romatoid artrit
6 ay ve 24 ay süreli 2 kontrollü klinik çalışmada, günde iki kez 5 mg tofasitinib monoterapisi grubunda gözlenen ciddi enfeksiyon oranı, 100 hasta yılı başına 1,7 olaydır. Aynı oran; günde iki kez 10 mg tofasitinib monoterapisi grubunda, 100 hasta yılı başına 1,6 olay iken, plasebo grubunda 100 hasta yılı başına 0 olay olarak gerçekleşmiştir. MTX grubunda ise bu oran 100 hasta yılı başına 1,9 olay olmuştur.
6, 12 veya 24 ay süreli çalışmalarda, günde iki kez 5 mg ve 10 mg tofasitinib artı DMARD gruplarındaki ciddi enfeksiyon oranları 100 hasta yılı başına sırasıyla 3,6 ve 3,4 olay iken, plasebo ile birlikte DMARD uygulanan grupta 100 hasta yılı başına 1,7 olay olarak gerçekleşmiştir.
İlaca maruz kalan tüm popülasyonlardaki güvenlilik verilerinde, ciddi enfeksiyonların genel oranları günde iki kez 5 mg ve günde iki kez 10 mg tofasitinib tedavisi alan gruplar için 100 hasta yılı başına sırasıyla 2,4 ve 3,0 olay olmuştur. En yaygın görülen ciddi enfeksiyonlar arasında, pnömoni, herpes zoster, idrar yolu enfeksiyonu, selülit, gastroenterit ve divertikülit yer almıştır. Fırsatçı enfeksiyonlar da bildirilmiştir (bkz. bölüm 4.4).
Yaşlı hastalarda ciddi enfeksiyonlar
Çalışma I ila VI'ya dahil edilmiş olan 4,271 RA hastasının 608'i 65 yaş ve üzerinde, bu hastaların da 85'i 75 ve üzeri yaştadır. Tofasitinib ile tedavi edilen 65 yaş ve üzeri hastalarda gözlenen ciddi enfeksiyon sıklığı, 65 yaş altı hastalarda görülenden daha yüksek olmuştur (sırasıyla 100 hasta yılı başına 4,8 olaya karşı 100 hasta yılı başına 2,4 olay). Genel olarak yaşlı popülasyonda enfeksiyon insidansı daha yüksek olduğundan, bu grup hastaların tedavisi sırasında dikkatli olunmalıdır (bkz. bölüm 4.4).
Girişimsel olmayan onay sonrası güvenlilik çalışmasından kaynaklanan ciddi enfeksiyonlar Bir kayıttan (US Corrona) RA hastalarında tofasitinibi değerlendiren onay sonrası girişimsel olmayan bir güvenlik çalışmasından elde edilen veriler, günde bir kez uygulanan 11 mg tofasitinib için günde iki kez uygulanan 5 mg tofasitinibe kıyasla oran olarak daha yüksek ciddi enfeksiyon insidansı gözlemlendiğini göstermiştir.
Tedavinin başlangıcından 12 ay sonra her bir formülasyonun uygunluğundan elde edilen ham insidans oranları (%95 GA) (örneğin yaş ve cinsiyete göre ayarlanmamış) günde bir kez 11 mg tofasitinib ve günde iki kez 5 mg tofasitinib gruplarında sırasıyla 100 hasta yılı başına 3,45 (1,93, 5,69) ve 2,78 (1,74, 4,21) ve 36. ayda 4,71 (3,08, 6,91) ve 2,79 (2,01, 3,77) olaydır.
Günde iki kez 5 mg tofasitinibe kıyasla günde 1 kez 11 mg tofasitinib için ayarlanmamış tehlike oranı 12. ayda 1,30 (%95GA:0,67, 2,50) ve 36. ayda 1,93 (%95GA: 1,15, 3,24)'tür. Veriler,
nispeten büyük güven aralıkları ve sınırlı takip süresi ile gözlemlenen olaylara sahip az sayıda hastaya dayanmaktadır.
Viral reaktivasyon
Tofasitinib ile tedavi edilen Japon ve Koreli hastalarda veya daha önce iki veya daha fazla biyolojik DMARD almış olan uzun süreli RA hastalarında, ALC değeri 1,000 hücre/mm'ten az olan hastalarda ve günde iki kere 10 mg doz alan hastalarda herpes zoster riski daha yüksek olabilir (bkz. bölüm 4.4).
En az bir ek kardiyovasküler risk faktörü olan 50 yaş ve üzerindeki RA hastalarında yapılan büyük (N=4,362) bir ruhsatlandırma sonrası güvenlilik çalışmasında, TNF inhibitörlerine kıyasla tofasitinib ile tedavi edilen hastalarda herpes zoster olaylarında bir artış gözlenmiştir. Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri ile 100 hasta-yılı için herpes zoster vakalarının ortaya çıkış sıklığı (%95 CI), sırasıyla 3,75 (3,22, 4,34), 3,94 (3,38, 4,57), ve 1,18 (0,90, 1,52) hastadır.
Laboratuvar testleri
Lenfositler
Kontrollü RA klinik çalışmalarında, günde iki kez hem 5 mg hem de 10 mg tofasitinib gruplarında yer alan hastaların %0,3'ünde ALC değerleri 500 hücre/mm seviyesinin altına düşmüş ve %1,9 hastada ise ALC değeri 500-750 hücre/mm arasında çıkmıştır.
Uzun dönem RA güvenlilik popülasyonunda, günde iki kez hem 5 mg hem de 10 mg tofasitinib gruplarında yer alan hastaların %1,3'ünde ALC değerleri 500 hücre/mm seviyesinin altına düşmüş ve %8,4 hastada ise ALC değeri 500-750 hücre/mm arasında çıkmıştır.
ALC değerinin 750 hücre/mm'ün altına inmesi, ciddi enfeksiyonların artışı ile ilişkili bulunmuştur (bkz. bölüm 4.4).
Nötrofiller
Kontrollü RA klinik çalışmalarda, günde iki kez hem 5 mg hem de 10 mg tofasitinib gruplarında yer alan hastaların %0,08'inde ANC değerleri, 1,000 hücre/mm seviyesinin altına düşmüştür. Herhangi bir tedavi grubunda ANC değeri 500 hücre/mm değerinin altına düşmemiştir. Nötropeni ve ciddi enfeksiyonların oluşumu arasında net bir ilişki izlenmemiştir.
Uzun dönem RA güvenlilik popülasyonunda, ANC'deki doğrulanmış düşüş insidansı, kontrollü klinik çalışmalarda görülenle tutarlı bir şekilde seyretmiştir (bkz. bölüm 4.4).
Trombositler
Faz 3 kontrollü klinik çalışmalarda kayıt adına uygun olmak için (RA, PsA) hastaların trombosit düzeyleri ≥100,000 hücre/mm olmalıdır. Bu nedenle, tofasitinib ile tedaviye başlamadan önce trombosit düzeyleri <100,000 hücre/mm olan hastalar için herhangi bir bilgi mevcut değildir.
Karaciğer enzimi testleri
RA hastalarında, karaciğer enzimlerinde normalin üst limitinin (ULN) üç katından daha fazla artış (3xULN) nadiren gözlenmiştir. Karaciğer enzimi artışı görülen bu hastalarda, eşlik eden DMARD dozunun azaltılması, tofasitinib tedavisine ara verilmesi ya da tofasitinib dozunun azaltılması gibi tedavi modifikasyonları, karaciğer enzimi seviyelerinin düşüşü ya da normal hale gelmesi ile sonuçlanmıştır.
RA Faz 3 monoterapi çalışmasının kontrollü bölümünde (0-3 ay) (Çalışma I, bkz. bölüm 5.1), plasebo, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %1,65, %0,41 ve
%0'ında >3xULN ALT artışı gözlenmiştir. Bu çalışmada, plasebo, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %1,65, %0,41 ve %0'ında >3x ULN AST artışı gözlenmiştir.
RA Faz 3 monoterapi çalışmasında (0-24 ay) (VI no'lu çalışma, (bkz. bölüm 5.1), MTX,
tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %7,1, %3,0 ve %3,0'ünde
>3xULN ALT artışı gözlenmiştir. Bu çalışmada, MTX, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %3,3, %1,6 ve %1,5'inde >3xULN AST artışı gözlenmiştir.
Eş zamanlı DMARD alan hastaların dahil edildiği RA Faz 3 çalışmalarının kontrollü bölümünde (0-3 ay) (Çalışma II-V, bkz. bölüm 5.1) plasebo, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %0,9, %1,24 ve %1,14'ünde >3xULN ALT artışı gözlenmiştir. Bu çalışmalarda plasebo, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla
%0,72, %0,5 ve %0,31'inde >3x ULN AST artışı gözlenmiştir.
Monoterapi ile yapılan uzun dönem RA uzatma çalışmalarında, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %1,1 ve %1,4'ünde >3xULN ALT artışı gözlenmiştir. Tofasitinib günde iki kez 5 mg ve 10 mg gruplarının her ikisinde de <%1,0 oranında >3xULN AST artışı gözlenmiştir.
Eş zamanlı DMARD alan hastaların dahil edildiği uzun dönem RA uzatma çalışmalarında, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %1,8 ve %1,6'sında >3xULN ALT artışı gözlenmiştir. Tofasitinib günde iki kez 5 mg ve 10 mg gruplarının ikisinde de <%1,0 oranında >3xULN AST artışı gözlenmiştir.
Lipidler
Lipid parametrelerindeki artışlar (toplam kolesterol, LDL kolesterol, HDL kolesterol, trigliseritler) ilk olarak kontrollü çift-kör RA klinik çalışmalarında tofasitinib başlanmasından sonraki birinci ayda değerlendirilmiştir. Bu zaman noktasında gözlenen artışlar ardından stabil seyretmiştir. Kontrollü RA klinik çalışmalarında çalışmanın başlangıcından sonuna kadar (6- 24 ay) olan süredeki lipid parametrelerinde ortaya çıkan değişiklikler aşağıda özetlenmiştir:
En az bir ek kardiyovasküler risk faktörü olan 50 yaş ve üzerindeki RA hastalarında yapılan büyük bir (N=4,362) ruhsatlandırma sonrası güvenlilik çalışmasında, günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri alan hastaların sırasıyla %6,01,
%6,54 ve %3,77'de 3x ULN'ye eşit veya daha büyük ALT yükselmeleri gözlenmiştir. Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri alan hastaların
sırasıyla %3,21, %4,57 ve %2,38'inde 3x ULN'ye eşit veya daha büyük AST yükselmeleri
gözlendi.
Ortalama LDL kolesterol değeri 12.ayda tofasitinib günde iki kez 5 mg kolunda %15 ve tofasitinib günde iki kez 10 mg kolunda %20 ve 24. ayda tofasitinib günde iki kez 5 mg kolunda %16 ve tofasitinib günde iki kez 10 mg kolunda %19 artmıştır.
Ortalama HDL kolesterol değeri 12.ayda tofasitinib günde iki kez 5 mg kolunda %17 ve tofasitinib günde iki kez 10 mg kolunda %18 ve 24. ayda tofasitinib günde iki kez 5 mg kolunda %19 ve tofasitinib günde iki kez 10 mg kolunda %20 artmıştır.
Tofasitinib tedavisinin bırakılmasını takiben lipid seviyeleri başlangıç düzeyine dönmüştür. Tofasitinib ile tedavi edilen hastalarda ortalama LDL/HDL kolestrol oranları ve Apolipoprotein
B (ApoB)/ApoAoranları esasen değişmemiştir.
Kontrollü bir RA klinik çalışmasında, LDL kolestrol ve Apo B seviyelerindeki artışlar, statin tedavisi ile tedavi öncesi seviyelere düşmüştür.
Uzun dönem RA güvenlilik popülasyonunda, lipid parametrelerdeki artışlar, kontrollü klinik çalışmalarda gözlenenler ile tutarlı bir şekilde seyretmiştir.
En az bir ek kardiyovasküler risk faktörü olan 50 yaş ve üzeri RA'lı hastalarda yapılan büyük (N=4,362) bir ruhsatlandırma sonrası güvenlilik çalışmasında, başlangıçtan 24 aya kadar lipid parametrelerindeki değişiklikler aşağıda özetlenmiştir:
Ortalama LDL kolesterol, günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib
ve TNF inhibitörü alan hastalarda 12 ayda sırasıyla %13,80, %17,04 ve %5,50; 24 ayda
sırasıyla %12,71, %18,14 ve %3,64 artmıştır.
Ortalama HDL kolesterol, günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörü alan hastalarda 12 ayda sırasıyla %11,71, %13,63 ve %2,82; 24 ayda
sırasıyla %11,58, %13,54 ve %1,42 artmıştır.
Miyokardiyal enfarktüsü
Romatoid artrit
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan geniş (N=4,362) randomize ruhsat onayı sonrası güvenlilik çalışmasında, günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için ölümcül olmayan miyokardiyal enfarktüs insidans oranları (%95 GA) her 100 hasta yılı başına sırasıyla 0,37 (0,22, 0,57), 0,33 (0,19, 0,53) ve 0,16 (0,07, 0,31) olaylı hastadır. TNF inhibitörlerine kıyasla tofasitinib ile tedavi edilen hastalarda az sayıda ölümcül miyokardiyal enfarktüsü benzer oranlarda raporlanmıştır (bkz. bölüm 4.4 ve 5.1). Bu çalışma, en az 1500 hastanın 3 yıl boyunca takip edilmesini gerektirmiştir.
NMSC harici maligniteler
Romatoid artrit
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan geniş (N=4,362) randomize ruhsat onayı sonrası güvenlilik çalışmasında, günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için akciğer kanseri insidans oranları (%95 GA) her 100 hasta yılı başına sırasıyla 0,23 (0,12, 0,40), 0,32 (0,18, 0,51) ve 0,13
(0,05, 0,26) olaylı hastadır (bkz. bölüm 4.4 ve 5.1). Bu çalışma, en az 1500 hastanın 3 yıl boyunca takip edilmesini gerektirmiştir.
Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için
lenfoma insidans oranları (%95 GA) her 100 hasta yılı için sırasıyla 0,07 (0,02, 0,18), 0,11
(0,04, 0,24) ve 0,02 (0,00, 0,10) olaylı hastadır (bkz. bölüm 4.4 ve 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi'ne (TÜFAM) bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Doz aşımı durumunda, hastanın advers reaksiyon belirti ve semptomları açısından izlenmesi tavsiye edilmektedir. Tofasitinib doz aşımı için spesifik bir antidot yoktur. Tedavi, semptomatik ve destekleyici olmalıdır.
Sağlıklı gönüllülerde 100 mg'a kadar (100 mg dahil) tek doz uygulama sonucu elde edilen farmakokinetik verilere göre, uygulanan dozun %95'inden fazlasının 24 saat içinde elimine edilmesi beklenmektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
ATC kodu: L04AA29
Farmakoterapötik grup: Antineoplastik ve İmmünomodülatör Ajanlar, Selektif İmmünosüpresanlar.
Etki mekanizması
Tofasitinib, JAK ailesinin güçlü, selektif bir inhibitörüdür. Enzim tayinlerinde tofasitinib, JAK1, JAK2, JAK3 ve daha düşük oranda olmak üzere TyK2'yi inhibe eder. Buna karşılık, tofasitinib, insan genomundaki diğer kinazlara karşı yüksek derecede seçiciliğe sahiptir. Tofasitinib, insan hücrelerinde, tercihen fonksiyonel seçicilik göstererek JAK2 çiftleri olarak sinyal ileten sitokin reseptörleri yerine JAK3 ve/veya JAK1 ile ilişkili heterodimerik sitokin reseptörleri ile sinyal iletimini inhibe eder. Tofasitinib ile JAK1 ve JAK3'ün inhibisyonu, interlökinlerin (IL-2, -4, -7,- 9, -15 ve -21) ve tip I ve tip II interferonların ilettiği sinyalleri azaltır ve bu da immün ve inflamatuvar yanıtın modülasyonu ile sonuçlanır.
Farmakodinamik etkiler
RA hastalarında 6 aya kadar olan tofasitinib tedavisi, dolaşımdaki CD16/56+ doğal öldürücü (NK) hücre sayısında doza bağlı düşüşler ile ilişkilidir, tahmini maksimum düşüşler tedavi başlangıcından yaklaşık 8-10 hafta sonra gerçekleşir. Bu değişiklikler genellikle tedavinin sonlandırılmasından 2-6 hafta sonra ortadan kalkar. Tofasitinib ile tedavi, B hücre sayılarında doza bağlı artış ile ilişkilidir. Dolaşımdaki T-lenfosit sayıları ve T-lenfosit alt tiplerindeki (CD3+, CD4+, CD8+) değişiklikler az miktarda ve tutarsız karakterdedir.
Uzun süreli tedaviyi (tofasitinib tedavisinin ortalama süresi yaklaşık 5 yıl) takiben CD4+ ve CD8+ sayılarında ortalama azalma başlangıçtan itibaren sırasıyla %28 ve %27 oranında gözlenmiştir. Kısa süreli dozlamayı takiben gözlemlenen düşüşün aksine, CD16/56+ doğal öldürücü hücre sayılarında başlangıçtan itibaren ortalama %73'lük bir artış gözlenmiştir. CD19+B hücrelerinin sayısında uzun süreli tofasitinib tedavisinden sonra başka artışlar gözlenmemiştir. Lenfosit alt tiplerindeki tüm değişiklikler, tedavinin geçici olarak kesilmesini takiben başlangıç değerine doğru geri dönmüştür. Ciddi veya fırsatçı herpes zoster enfeksiyonları ve lenfosit alt tiplerinin sayısı arasında ilişki olduğuna dair bir kanıt yoktur (ALC değeri takibi için bkz. bölüm 4.2).
RA hastalarına 6 aylık tofasitinib dozu sonrası toplam serum IgG, IgM ve IgA seviyelerindeki değişiklikler küçüktür, doz bağımlı değildir ve plaseboda görülenlerle benzerdir ki bu da sistemik humoral supresyonun yokluğuna işaret etmiştir.
RA hastalarında tofasitinib ile tedaviyi takiben, serum C-reaktif proteini seviyelerinde (CRP) hızlı bir düşüş gözlenmiş ve bu düşüş tedavi boyunca sürdürülmüştür. Tofasitinib tedavisi ile gözlenen CRP değişiklikleri, tedavi durdurulduktan sonraki 2 hafta içinde tam olarak eski haline dönmemiştir, bu da ilacın yarı ömrü ile karşılaştırıldığında daha uzun bir farmakodinamik aktivite süresini işaret etmektedir.
Aşı çalışmaları
Günde iki kez 10 mg tofasitinib veya plasebo ile tedavi başlatılan RA hastaları üzerinde gerçekleştirilen kontrollü bir klinik çalışmada, influenza aşısına yanıt verenlerin sayısı her iki grupta benzerdir: Tofasitinib (%57) ve plasebo (%62). Pnömokokal polisakkarit aşısına yanıt verenlerin sayısı şöyledir: hem tofasitinib hem de MTX alan hastalarda %32; tofasitinib monoterapisi alan hastalarda %62; MTX monoterapisi alan hastalarda %62 ve plasebo alan hastalarda %77'dir. Bunun klinik açıdan anlamı bilinmemekle beraber, uzun süre boyunca günde iki kez 10 mg tofasitinib alan hastalarda influenza ve pnömokokal polisakkarit aşıları ile yapılan ayrı bir aşı çalışmasında da yine benzer sonuçlar alınmıştır.
RA hastalarında, günde iki kez 5 mg tofasitinib veya plasebo ile 12 haftalık tedavi başlatılmadan 2 ila 3 hafta öncesinde canlı atenüe bir herpes virüs aşısı ile immünize edilmiş daha önce MTX kullanan hastalar üzerinde kontrollü bir çalışma yapılmıştır. 6. haftada hem tofasitinib ve hem de plasebo ile tedavi edilen hastalarda VZV'ye humoral ve hücresel yanıtlara dair kanıtlar görülmüştür. Bu yanıtlar 50 yaş ve üzeri sağlıklı gönüllülerde gözlemlenmiş olanlara benzerdir. Geçmişte varisella enfeksiyonu öyküsü ve başlangıç seviyesinde anti- varisella antikoru bulunmayan bir hastada aşılamadan 16 gün sonra varisellanın aşı suşunun yayılımı gözlenmiştir. Tofasitinib tedavisi kesilmiş ve hasta standart antiviral ilaç tedavisi
sonrası iyileşmiştir. Bu hasta daha sonra aşıya gecikmiş olsa da sağlam, hümoral ve hücresel bir yanıt vermiştir (bkz. bölüm 4.4).
Klinik etkililik ve güvenlilik
Romatoid artrit
Tofasitinib film kaplı tabletin etkililik ve güvenliliği, 18 yaşından büyük ve Amerikan Romatoloji Derneğinin kriterlerine göre aktif RA tanısı konmuş hastaların dahil olduğu 6 randomize, çift-kör, çok merkezli klinik çalışmada değerlendirilmiştir. Tablo 4'te çalışma tasarımına ve popülasyonun özelliklerine dair bilgiler bulunmaktadır.
Tablo 4: RA'lı hastalarda günde iki defa 5 mg ve 10 mg tofasitinib dozlarının faz 3 klinik çalışmaları
Çalışmalar | Çalışma I (ORAL Solo) | Çalışma II (ORAL Sync) | Çalışma III (ORAL Standar d) | Çalışma IV (ORAL Scan) | Çalışma V (ORAL Step) | Çalışma VI (ORAL Start) | Çalışma VII (ORAL Strategy) |
Popülasyon |
DMARD- IR |
DMARD- IR |
MTX-IR |
MTX-IR |
TNFi-IR | MTX-naifa |
MTX-IR |
Kontrol | Plasebo | Plasebo | Plasebo | Plasebo | Plasebo | MTX | MTX, ADA |
Önceki tedavi | Yok | csDMAD'la r | MTX | MTX | MTX | Yok | 3 Paralel kollu: +MTX |
Önemli özellikler | Monoterapi | Çeşitli csDMARD 'lar | Aktif kontrol (ADA) | X-Ray | TNFi-IR | Monoterapi, Aktif komperatör (MTX), X-Ray | MTX'li ve MTX'siz tofasitinibin MTX'li ADA ile karşılaştırılması |
Tedavi alan hasta sayısı) | 610 | 792 | 717 | 797 | 399 | 956 | 1,146 |
Toplam çalışma süresi | 6 ay | 1 yıl | 1 yıl | 2 yıl | 6 ay | 2 yıl | 1 yıl |
Tofasitinib monoterapi
Tofasitinib
ADA+MTX
5.2. Farmakokinetik özellikler
Genel özelliklerTofasitinibin farmakokinetik profili, hızlı emilim (tepe plazma konsantrasyonlarına 0,5-1 saat içinde erişilmektedir), hızlı eliminasyon (yaklaşık 3 saatlik yarı ömür) ve sistemik maruziyette doz ile orantılı artışlar ile karakterizedir. Günde iki kez uygulama sonrasında kararlı durum konsantrasyonlarına 24-48 saat içinde ihmal edilebilir birikme ile erişilmektedir.
Emilim:
Tofasitinib iyi bir şekilde absorbe edilmektedir ve oral biyoyararlanımı %74'tür. Tofasitinibin yüksek yağ içerikli bir yemek ile birlikte alınması, EAA'da herhangi bir değişikliğe neden olmazken, C'ı %32 oranında azaltmıştır. Klinik çalışmalarda, tofasitinib yemekten bağımsız olarak uygulanmıştır.
Dağılım:
İntravenöz uygulamadan sonra dağılım hacmi 87 L'dir. Kanda dolaşan tofasitinibin yaklaşık
%40'ı plazma proteinlerine bağlanır. Tofasitinib, ağırlıklı olarak albümine bağlanmaktadır ve α1-asit glikoproteine bağlanıyor gibi görünmemektedir. Tofasitinib, alyuvarlar ve plazma arasında eşit olarak dağılmaktadır.
Biyotransformasyon:
Tofasitinib, esas olarak CYP3A4 aracılığıyla metabolize edilir; CYP2C19'un minör bir katkısı vardır. İnsanlar üzerinde yapılan bir radyoaktif işaretleme çalışmasında, dolaşımdaki toplam radyoaktivitenin %65'inden fazlası değişmemiş etkin maddeye, geri kalan %35'i, her biri
%8'den az radyoaktiviteye karşılık gelen 8 metabolite atfedilmiştir. Tüm metabolitler hayvan türlerinde gözlenmiştir ve JAK1/3 inhibisyonu için tofasitinibden 10 kat daha düşük bir güce sahip oldukları tahmin edilmektedir. İnsan örneklerinde stereo dönüşüm kanıtları tespit edilmemiştir. Tofasitinibin farmakolojik aktivitesi ana moleküle atfedilmiştir. In vitro ortamda tofasitinib MDR1 için bir substrat olmasına karşın meme kanseri direnç proteini (BCRP), OATP1B1/1B3 veya OCT1/2 için bir substrat inhibitör değildir.
Eliminasyon:
Tofasitinib için klirens mekanizmaları yaklaşık %70 hepatik metabolizma ve ana ilacın
%30'unun böbrek yoluyla atılması şeklindedir.
Doğrusallık / Doğrusal olmayan durum:
Geçerli değildir.
Hastalardaki karakteristik özellikler
Hastalardaki farmakokinetik
CYP enzimlerinin enzimatik aktivitesi RA hastalarında kronik inflamasyon dolayısıyla azalmaktadır. RA hastalarında, tofasitinibin oral klirensi zamanla değişmemektedir ki bu da tofasitinib ile tedavinin CYP enzim aktivitesini normalleştirmediğine işaret etmektedir.
RA hastaları üzerinde yapılan popülasyon PK analizi vücut ağırlığının aşırı uçlarında (40 kg, 140 kg) tofasitinibin sistemik maruziyetinin (EAA) 70 kg bir hastanınkine benzer (%5 dahilinde) olduğunu göstermiştir. 80 yaşındaki yaşlı hastaların EAA değerinin 55 yaş şeklindeki ortalamaya göre %5'ten düşük bir oranda daha az olduğu tahmin edilmiştir. Kadınların EAA değerinin erkeklere oranla %7 daha düşük olduğu öngörülmektedir. Mevcut veriler, Beyaz, Siyah ve Asyalı hastalar arasında tofasitinib EAA değeri açısından önemli
farklar bulunmadığını göstermiştir. Vücut ağırlığı ve dağılım hacmi arasında, daha hafif hastalarda daha yüksek pik (C) ve daha düşük dip (C) konsantrasyonlar ile sonuçlanan, neredeyse lineer bir ilişki gözlenmiştir. Ancak, bu fark klinik açıdan ilgili kabul edilmemiştir. Tofasitinibin EAA değeri açısından gönüllüler arasındaki değişkenlik (yüzde varyasyon katsayısı) yaklaşık %27 olarak tahmin edilmektedir.
Aktif PsA'lı hastalarda PK analizi popülasyonundan elde edilen sonuçlar RA hastalarından elde edilenler ile tutarlıdır.
Böbrek yetmezliği
Hafif (kreatinin klirensi 50-80 mL/dak), orta (kreatinin klirensi 30-49 mL/dak) ve şiddetli (kreatinin klirensi <30 mL/dak) böbrek yetmezliği olan bireylerde EAA değerinde, sağlıklı bireylerle karşılaştırıldığında sırasıyla %37, %43 ve %123 oranında artış gözlenmiştir (bkz. bölüm 4.2). Son evre böbrek yetmezliği (SEBY) olan bireylerde, diyalizin tofasitinib toplam klirensine katkısı göreceli olarak az olmuştur. 10 mg'lık tek bir dozu takiben, SEBY'li bireylerde diyaliz olmayan günlerde ölçülen konsantrasyonlara dayalı ortalama EAA normal böbrek fonksiyonu olan bireylere kıyasla yaklaşık %40 oranında daha yüksektir (%90 güven aralıkları: %1,5-95). Klinik çalışmalarda tofasitinib başlangıç kreatinin klirens seviyeleri (Cockroft-Gault denklemi ile tahmin edilen şekilde) 40 mL/dakikadan az olan hastalarda değerlendirilmemiştir (bkz. bölüm 4.2).
Karaciğer yetmezliği
Hafif (Child Pugh A) ve orta derecede (Child Pugh B) karaciğer yetmezliği olan bireylerde EAA değerinde, normalkaraciğer fonksiyonuna sahipolan bireylerle karşılaştırıldığında sırasıyla %3 ve %65 oranında artış gözlenmiştir. Klinik çalışmalarda, tofasitinib şiddetli (Child Pugh C) karaciğer yetmezliği olan hastalarda (bkz. bölüm 4.2 ve 4.4), veya hepatit B ya da C için pozitif sonuç alınan hastalarda değerlendirilmemiştir.
İlaç etkileşimi
Tofasitinib CYP'ler için (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ve
CYP3A4) bir inhibitör veya indükleyici UGT'ler için (UGT1A1, UGT1A4, UGT1A6, UGT1A9 ve UGT2B7) bir inhibitör değildir. Tofasitinib klinik olarak anlamlı konsantrasyonlarda MDR1, OATP1B1/1B3, OCT2, OAT1/3 veya MRP için bir inhibitör değildir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı çalışmalarda, bağışıklık ve hematopoietik sistemlerde tofasitinibin farmakolojik özellikleri (JAK inhibisyonu) ile ilişkilendirilen etkiler gözlenmiştir. Klinik ile ilişkilendirilebilecek dozlarda, bakteriyel ve viral enfeksiyonlar ve lenfoma gibi immünosüpresyondan kaynaklanan ikincil etkiler görülmüştür. Lenfoma 8 yetişkin maymunun 3'ünde klinik tofasitinib maruziyet seviyesinin 6 katında (insanlarda günde iki kez 5 mg dozunda bağlı olmayan EAA) görülmüştür ve klinik maruziyet seviyesinin 5 katında 14 genç maymunun hiçbirinde görülmemiştir. Lenfomalar için Hiç Advers Etki Gözlenmeyen Seviyede (NOAEL) maymunlarda maruziyet günde iki kez 5 mg veya 10 mg yaklaşık olarak klinik maruziyet seviyesinin 1 veya 0,5 katına eşittir. İnsanlara uygulanan dozların oldukça üzerinde olan dozlar ile ortaya çıkan diğer bulgular arasında karaciğer ve gastrointestinal sistemler
üzerindeki etkiler yer almıştır.
Gen mutasyonlarıve krozomalaberasyonlara yönelik yapılan bir dizi in vitro ve in vivo testlerin bulgularına göre, tofasitinib mutajenik veya genotoksik değildir.
Tofasitinibin karsinojenik potansiyeli 6 aylık rasH2 transjenik fare ve 2 yıl süreli sıçan karsinojenite çalışmalarında değerlendirilmiştir. Tofasitinib günde iki kere 5 mg veya 10 mg dozlarda maruziyet seviyesinin 38 katı veya klinik maruziyet seviyesinin 19 katı kadar olan seviyelerde sıçanlarda karsinojenik değildir. Sıçanlarda benign testiküler interstisyel (Leydig) hücre tümörleri gözlenmiştir; sıçanlardaki benign Leydig hücre tümörleri insanlarda Leydig hücre tümörleri riski ile bağlantılı değildir. Hibernomalar (kahverengi yağ dokusunun malignitesi) günde iki kere 5 mg veya 10 mg dozlarda maruziyet seviyesinin 83 katı veya klinik maruziyet seviyesinin 41 katı seviyelerinde dişi sıçanlarda gözlenmiştir. Dişi sıçanlarda günde iki kere 5 mg veya günde iki kere 10 mg dozlarda klinik maruziyet seviyesinin 187 veya 94 katı seviyelerinde benign timomalar görülmüştür.
Tofasitinibin sıçanlar ve tavşanlarda teratojenik olduğu ve sıçanlarda dişi fertilitesini (azalan gebelik oranı; corpora lutea, implantasyon yeri ve canlı fetüs sayılarında düşüş ve erken resorpsiyonlarda artış), partürisyonu ve peri/postnatal gelişimi etkilediği gösterilmiştir. Tofasitinibin erkek fertilitesi, sperm motilitesi veya sperm konsantrasyonu üzerinde bir etkisi yoktur. Tofasitinib, emziren sıçanların sütünde dozu takip eden 1 ila 8 saatte, serumdakilerin yaklaşık 2 katı konsantrasyonlarda atılmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mikrokristalin selüloz PH 102**
Laktoz monohidrat (inek sütünden elde edilmiştir)
Kroskarmelloz sodyum Magnezyum stearat Film Kaplama:
HPMC 2910/Hipromelloz Titanyum dioksit
Laktoz monohidrat (inek sütünden elde edilmiştir)
Polietilen glikol/Makrogol Triacetin
6.2. Geçimsizlikler
Mevcut değildir.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25 °C'nin altındaki oda sıcaklığında orijinal ambalajında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Primer ambalaj, PA/AL/PVC â Alu blister ambalajdadır. JANDARK 5 mg'lık film kaplı
tabletler halinde 56 tabletlik blister ambalajlarda takdim edilmiştir.
Sekonder ambalaj karton kutuda takdim edilmiştir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| TOFANZI | 8699511099218 | 7,389.67TL |
| TOFIK | 8680199002010 | 7,916.59TL |
| XELJANZ | 8681308090003 | 8,169.02TL |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
İlko İlaç San. ve Tic. A.Ş.
| Satış Fiyatı | 7780.03 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 7780.03 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699680091907 |
| Etkin Madde | Tofacitinib |
| ATC Kodu | L04AA29 |
| Birim Miktar | 5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |