IPRATOM 500 mcg/2 ml nebulizasyon için tek dozluk inhilasyon çöz. içeren 20 flakon Kısa Ürün Bilgisi
{ Ipratropium Bromur Monohidrat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
İPRATOM 500mcg/2ml nebülizasyon için tek dozluk inhalasyon çözeltisi içeren flakon
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tek dozluk flakon;
500 mcg ipratropium bromür anhidre eşdeğer, 522 mcg ipratropium bromür monohidrat içerir.
Yardımcı maddeler
Sodyum klorür 17 mg
Yardımcı maddeler için 6.1.'e bakınız.
3. FARMASÖTİK FORMU
Nebülizasyon için tek dozluk inhalasyon çözeltisi içeren flakon Berrak, renksiz veya hemen hemen renksiz çözelti.
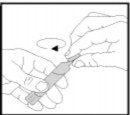
Tek dozluk flakonu, uç kısmını sertçe bükerek açınız. Bunu yaparken flakonu daima dik tutunuz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
İPRATOM, kronik obstrüktif akciğer hastalığına (KOAH) bağlı geri dönüşlü bronkospazmın tedavisinde endikedir.
İPRATOM, inhale beta2-agonist ilaçlar ile birlikte kullanıldığında, akut ve kronik astımda olduğu gibi, solunum yollarının geri dönüşlü obstrüksiyonunun tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi:
Dozaj, hastanın bireysel ihtiyaçlarına göre ayarlanmalıdır. 12 yaşındaki veya daha küçük çocuklarda, sadece İPRATOM 250mcg/2ml formu kullanılmalıdır.
Doktor tarafından başka türlü reçete edilmediği takdirde, aşağıdaki dozlar önerilmektedir: Erişkinler (yaşlılar dahil) ve 12 yaşından büyük çocuklar:
250 mcg-500 mcg (yani, İPRATOM 250mcg/2ml formundan 1 flakon veya İPRATOM 500mcg/2ml formundan 1 flakon), günde 3 ya da 4 kez.
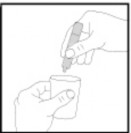
Tek dozluk flakonun içeriğini, nebülizörün kabına sıkarak tamamen boşaltınız. Eğer farklı bir miktarda kullanmanız gerekirse doktorunuz bunu size söyleyecektir.
Eğer size, salbutamol gibi, âkısa etkili beta2-agonist nebülizör çözeltisiâ adı verilen bir ilaç daha reçete edilmişse, bu sıvılar aynı nebülizör kabında karıştırılabilir.
Eğer doktorunuz ilacı seyreltmeniz gerektiğini söylerse, size âsteril %0,9'luk sodyum klorür çözeltisiâ verilecektir. Doktorunuz size seyreltmeyi nasıl yapacağınızı anlatacaktır.
4.3. Kontrendikasyonlar
İPRATOM, atropin veya türevlerine ya da ilacın bileşenlerinden herhangi birine karşı aşırı duyarlı olduğu bilinen hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Nebülizör çözeltisi ile doz uygulamasının başlangıç aşamalarında hasta, yakın tıbbi gözetim altında tutulmalıdır.
İPRATOM uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Aşırı duyarlılık reaksiyonları deri döküntüleri, ürtiker, anjiyoödem, orofarenjiyal ödem, bronkospazm ve anafilaksi vakaları şeklinde görülmüştür.
Antikolinerjik bir ilaç olan İPRATOM dar açılı glokoma karşı predispoze olan veya dar açılı glokomu bulunanlarda, ya da önceden üriner kanal çıkış obstrüksiyonu (örneğin, prostat hiperplazisi veya mesane boynu obstrüksiyonu) bulunan hastalarda dikkatle kullanılmalıdır.
Kistik fibrozlu hastalar, gastrointestinal motilite bozuklukları gelişmesine daha meyilli olabildiğinden, İPRATOM, diğer antikolinerjiklerle olduğu gibi, bu hastalarda dikkatle kullanılmalıdır.
Oküler komplikasyonlar
Aerosol şeklindeki ipratropium bromürün nebülizör tedavisi sırasında, tek başına veya bir adrenerjik beta2-agonist ile birlikte kullanıldığında göze temas etmesi sonucunda oküler komplikasyonlar (midriyazis, göz içi basıncında yükselme, dar-açılı glokom, göz ağrısı) geliştiği bildirilen izole vakalar vardır.
Konjonktivada konjesyon ve korneada ödem sonucu gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde görülürse, miyotik damlalar ile tedaviye başlanmalı ve hemen bir uzman hekimin görüşü alınmalıdır.
Hastalara İPRATOM'un doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Çözeltinin veya buğusunun göze temas etmemesi için dikkatli olunması gereklidir. İnhalasyon çözeltisinin bir ağızlık parçası aracılığıyla kullanılması önerilir. Eğer ağızlık parçası yoksa ve bir nebülizör maskesi kullanılacaksa, bu maskenin hastanın yüzüne tam olarak oturması gereklidir. Glokoma karşı predispoze olabilecek hastalar, gözlerini korumaları konusunda özellikle uyarılmalıdırlar.
Diğer inhalasyon tedavilerinde olduğu gibi, dozlamanın hemen ardından, ani hırıltı artışı ile ortaya çıkan ve inhalasyonla indüklenen bronkokonstriksiyon görülebilir. Bu duruma, hızlı etkili bir inhalasyon bronkodilatörü ile derhal müdahale edilmelidir. İPRATOM derhal kesilmeli, hasta değerlendirilmeli ve eğer gerekli ise, alternatif tedaviye başlanmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İpratropium bromürün beta-adrenerjikler ve ksantin preparatları ile birlikte uygulanmasının additif bir bronkodilatör etki yaratabileceğine dair kanıtlar bulunmaktadır.
Dar-açılı glokom öyküsü olan hastalarda nebülize ipratropium bromür ve beta2-agonistler aynı anda kullanıldığında, akut glokom riski (bkz. Bölüm 4.4) artabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel veri bulunmamaktadır.
Pediyatrik popülasyon:
Özel veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi
İpratropium bromürün insanlarda, gebelik sırasındaki güvenliliği halen gösterilmemiştir. Doğrulanmış bir gebelik sürecince ya da bir gebelik kuşkusunda İPRATOM kullanımının yararları, doğmamış bebek üzerindeki olası tehlikelere karşı tartılmalıdır. İPRATOM için, gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik veya embriyonal ve/veya fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3). Preklinik çalışmalarda, insanlarda önerilen dozlardan belirgin ölçüde yüksek dozların inhalasyon yoluyla ya da intranazal olarak uygulanmasından sonra hiçbir embriyotoksik veya teratojenik etki görülmemiştir.
Gebe kadınlara verilirken tedbirli olunmalıdır.
Laktasyon dönemi
İPRATOM'un süte geçip geçmediği bilinmemektedir. İpratropium bromürün bebeğe önemli bir miktarda geçmesi beklenmez. Bununla birlikte, bebeğini emziren bir anneye İPRATOM verilirken dikkatli olunması gereklidir.
Üreme yeteneği/Fertilite
İpratropium bromür ile yürütülen klinik öncesi çalışmalarda fertilite üzerinde advers etki görülmemiştir (bkz. Bölüm 5.3). İpratropium bromür için fertilite konusunda klinik veri bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araba ve makine kullanma becerileri üzerindeki etkileri konusunda çalışma yapılmamıştır. Ancak hastalar, İPRATOM tedavisi sırasında baş dönmesi, akomodasyon bozukluğu, midriyazis ve bulanık görme gibi istenmeyen etkilerin ortaya çıkabileceği konusunda uyarılmalıdır. Bu nedenle, araba kullanırken ya da makine işletirken dikkatli olmaları tavsiye edilmelidir. Eğer hastalarda yukarıda sözü edilen yan etkiler ortaya çıkarsa, araba kullanma ya da makine işletme gibi tehlike potansiyeli taşıyan işlerden uzak durmalıdırlar.
4.8. İstenmeyen etkiler
Tüm ilaçlarla olduğu gibi, İPRATOM kullanımı ile istenmeyen etkiler ortaya çıkabilir. Ancak bu etkiler ilacı kullanan herkeste görülmeyebilir.
Listelenen istenmeyen etkilerin birçoğu İPRATOM'un antikolinerjik özelliklerine bağlanabilir. İnhalasyon yoluyla uygulanan bütün ilaçlar gibi, İPRATOM lokal irritasyon semptomlarına yol açabilir. Advers ilaç reaksiyonları, klinik araştırmalarda ve ilacın onay sonrası kullanım dönemindeki farmakovijilans çalışmalarında elde edilen verilerden tanımlanmıştır.
Klinik araştırmalarda en sık bildirilen yan etkiler baş ağrısı, boğazda irritasyon, öksürük, ağız kuruluğu ve gastrointestinal motilite bozuklukları (konstipasyon, diyare ve kusma gibi), bulantı ve baş dönmesiydi.
Listelenen yan etkilerin sıklık oranları aşağıdaki gibidir:
Çok yaygın (≥1/10); yaygın (â¥1/100 ila <1/10); yaygın olmayan (â¥1/1,000 ila <1/100); seyrek (â¥1/10,000 ila <1/1,000), çok seyrek (<1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Aşırı duyarlılık, anafilaktik reaksiyon, dil, dudaklar ve yüzde anjiyoödem
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı, baş dönmesi
Göz hastalıkları
Yaygın olmayan: Bulanık görme, midriyazis, göz içi basıncında artış, glokom, göz ağrısı, haleler görme, konjonktival hiperemi, korneada ödem
Seyrek: Akomodasyon bozukluğu
Kardiyak hastalıklar
Yaygın olmayan: Palpitasyonlar, supraventriküler taşikardi Seyrek: Atriyal fibrilasyon, kalp hızında artış
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Yaygın: Boğazda irritasyon, öksürük
Yaygın olmayan: Bronkospazm, paradoksal bronkospazm, laringospazm, farenjiyal ödem, boğaz kuruluğu.
Gastrointestinal hastalıklar
Yaygın: Ağız kuruluğu, bulantı, gastrointestinal motilite bozukluğu Yaygın olmayan: Diyare, konstipasyon, kusma, stomatit
Deri ve deri altı doku hastalıkları Yaygın olmayan: Döküntü, pruritus Seyrek: Ürtiker.
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: İdrar retansiyonu
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Doz aşımına özgü hiçbir semptom ile karşılaşılmamıştır. İPRATOM'un geniş terapötik aralığı ve lokal olarak uygulandığı göz önüne alındığında, hiçbir ciddi antikolinerjik semptom beklenmez. Diğer antikolinerjiklerle olduğu gibi, ağız kuruluğu, gözde akomodasyon bozuklukları ve kalp hızında artış şeklinde doz aşımı semptomları ve belirtileri beklenebilir.
Nebülizörünüzü doktorunuzun anlattığı şekilde kullanınız.
5. FARMAKOLOJİK ÖZELLİKLER
İ5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antikolinerjikler ATC kodu: R03BB01
İpratropium bromür, antikolinerjik (parasempatolitik) özellikleri olan, bir katerner amonyum bileşiğidir. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen transmitter ajan olan asetilkolinin etkilerini antagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe eden bir bileşik olarak görünmüştür. Antikolinerjikler, asetilkolinin bronş düz kasları üzerindeki muskarinik reseptörlerle etkileşimi sonucu meydana gelen hücre içi Ca konsantrasyonu artışını önlerler. Ca salıverilmesine, IP(inozitol trifosfat) ve DAG (diaçilgliserol)'den oluşan ikinci elçi sistemi aracılık etmektedir.
İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak sistemik ilaç konsantrasyonlarıyla değil, bronş düz kasları üzerinde etki göstermeye yetecek lokal ilaç konsantrasyonlarıyla ortaya çıkar.
Klinik öncesi ve klinik çalışmalarda elde edilen veriler ipratropium bromürün, havayolları mukus sekresyonu, mukosiliyer klerens ya da gaz alışverişi üzerinde hiçbir zararlı etkisi olmadığını göstermiştir.
Kronik obstrüktif akciğer hastalığına bağlı geri dönüşlü bronkospazmı olan hastalarda ölçümlü doz inhaleri kullanılarak yürütülen klinik çalışmalarda, akciğer fonksiyonunda 15 dakika içerisinde belirgin iyileşmeler oluşmuş (FEV%15 veya daha fazla artmıştır), bu iyileşme 1-2 saat içinde doruğa ulaşmış ve yaklaşık 4 saat kadar kalıcı olmuştur.
İpratropium bromürün astıma bağlı akut bronkospazm tedavisindeki bronkodilatör etkisi, erişkinlerde ve 6 yaşından büyük çocuklarda yürütülen çalışmalar ile gösterilmiştir. İpratropium bromür bu çalışmaların çoğunluğunda inhale bir beta2-agonist ile kombine halde uygulanmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
İPRATOM'un terapötik etkisi, solunum yollarındaki lokal aktivite sonucunda ortaya çıkmaktadır. Bronkodilatasyon ve sistemik farmakokinetik parametrelerin zaman içindeki seyirleri, birbirine paralel gitmez.
İnhalasyondan sonra, formülasyona, cihaza ve inhalasyon tekniğine bağlı olmak üzere, genellikle dozun %10 ile %30'u akciğerde tutulur. Dozun büyük bölümü yutulur ve gastrointestinal kanala geçer.
Akciğerlerde tutulan doz bölümü, hızla dolaşıma geçer (dakikalar içinde).
Ana bileşiğin kümülatif renal atılımı (0-24 saat), intravenöz uygulanan dozun yaklaşık
%46'sı, oral dozun %1'den daha az miktarı ve inhale edilen dozun yaklaşık %3 ila 13'üdür. Bu verilere dayanarak, oral ve inhale ipratropium bromür dozlarıyla genel sistemik biyoyararlanımın, sırasıyla, %2 ve %7-%28 aralığında olduğu tahmin edilmektedir.
Bu durum dikkate alındığında, ipratropium bromür dozunun yutulan bölümü sistemik maruziyete önemli bir katkıda bulunmamaktadır.
Dağılım:
İlaç plazma proteinlerine minimal oranda bağlanır (%20'den düşük). Kuaterner amin olan ipratropium iyonu kan beyin bariyerini geçmez.
Biyotransformasyon:
İntravenöz uygulamadan sonra dozun yaklaşık %60'ı başlıca konjugasyonla olmak üzere (%40) metabolize olur. İnhalasyondan sonra ise, sistemik olarak bulunan dozun yaklaşık
%77'si ester hidrolizi (%41) ve konjugasyon (%36) ile metabolize edilir. İdrardaki başlıca metabolitler muskarinik reseptöre az miktarda bağlanır ve etkili olmadıkları kabul edilir.
Eliminasyon:
İpratropiumun ortalama total klerensi 2,3 l/dk ve renal klerensi 0,9 l/dk'dır. İpratropium bromürün HFA 134a ya da CFC propellanı ile birlikte inhalasyonundan sonra 24 saatlik kümülatif renal ekskresyonu, sırasıyla %12 ve %10 olmuştur.
Bir ekskresyon balans çalışmasında, ilaca bağlı radyoaktivitenin (ana bileşikler ve bütün metabolitler dahil olmak üzere) kümülatif renal ekskresyonu (6 gün), intravenöz uygulamadan sonra %72,1, oral uygulamadan sonra %9,3 ve inhalasyondan sonra %3,2 olmuştur. Feçes ile atılan total radyoaktivite, intravenöz uygulamadan sonra %6,3, oral uygulamadan sonra
%88,5 ve inhalasyondan sonra %69,4 olmuştur. İntravenöz uygulamadan sonra ilaca bağlı radyoaktivitenin ekskresyonuyla ilgili olarak, ekskresyon başlıca böbrek yoluyla olmaktadır. İlaca bağlı radyoaktivitenin (ana bileşik ve metabolitler) eliminasyon yarı-ömrü 3,2 saattir.
Doğrusallık/Doğrusal olmayan durum:
Geçerli değil.
5.3. Klinik öncesi güvenlilik verileri
İpratropium bromürün toksisitesi, şu çalışma tipleriyle kapsamlı bir şekilde araştırılmıştır: oral, intravenöz, subkutan, intranazal ve/veya inhalasyon yolları ile akut, subkronik ve kronik
toksisite, karsinojenite, üreme toksisitesi ve mutajenisite. Bu toksisite çalışmalarına dayanarak, sistemik antikolinerjik yan etki olasılığı şu sırayla azalır: intravenöz > subkutan > oral > inhalasyon > intranazal.
Klinik öncesi çalışmalarda, ipratropium bromürün iyi tolere edildiği bulunmuştur. Sıçan ve farelerde yapılan iki yıllık karsinojenite çalışmaları, intranazal ipratropium için önerilen maksimum günlük insan dozunun yaklaşık 1.200 katına kadar dozlarda hiçbir karsinojenik aktivite göstermemiştir. Çeşitli mutajenisite testlerinin sonuçları negatiftir.
İpratropium bromürün fertilite, embriyo-fetotoksisite ve peri-postnatal gelişme üzerindeki muhtemel etkilerinin araştırıldığı çalışmalar, fareler, sıçanlar ve tavşanlar üzerinde yürütülmüştür.
Yüksek oral doz düzeyleri, yani sıçanlarda 1.000 mg/kg/gün ve tavşanlarda 125 mg/kg/gün, her iki türde de maternotoksik bulunmuştur. Sıçanlarda ise aynı zamanda fetal ağırlıkta azalma ile birlikte embriyo-fetotoksisite de görülmüştür. Tedaviye bağlı malformasyon gözlenmemiştir.
Ölçülü doz aerosolün, teknik olarak mümkün en yüksek inhalasyon dozları, sıçanlarda 1,5 mg/kg/gün (insan eşdeğer dozu 0,24 mg/kg/gün) ve tavşanlarda 1,8 mg/kg/gün (insan eşdeğer dozu 0,576 mg/kg/gün), üreme üzerinde hiçbir advers etki göstermemiştir.
Bu dozlar, 2 mg veya 0,04 mg/kg (50 kg'lık vücut ağırlığına dayanır)'lık önerilen maksimum günlük insan dozunun (MRHDD) 6 ve 14 katıdır.
İlacı kullandıktan sonra, nebülizörde arta kalan çözeltiyi dikkatle atınız. Nebülizörünüzü, imalatçısının talimatları doğrultusunda temizleyiniz. Nebülizörünüzü temiz tutmanız önemlidir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum klorür Hidroklorik asit Enjeksiyonluk su
6.2. Geçimsizlikler
İPRATOM ile koruyucu madde olarak benzalkonyum klorür içeren disodyum kromoglikat inhalasyon çözeltileri, aynı nebülizör içinde birlikte uygulanmamalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25ËC altındaki oda sıcaklığında saklayınız. Direkt gün ışığından koruyunuz. Flakonları karton ambalajı içinde saklayınız.
Ürün koruyucu içermediğinden, her doz için yeni bir flakon kullanılmalı ve flakon uygulamadan hemen önce açılmalıdır. Flakon açılıp ilk kez kullanıldıktan sonra kalan çözelti atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
İPRATOM, 20 adet tek dozluk 2 ml çözelti içeren 3 ml'lik flakonlarda kullanıma sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi atıkların kontrolü' ve âAmbalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ATROVENT | 8699693520050 | |
| COMBIVENT | 8699693520043 | |
| IPRABUL | 8680741520955 | |
| IPRACORT | 86801199526134 | |
| IPRATOM | 8699844521073 | 138.01TL |
| Diğer Eşdeğer İlaçlar |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Vem İlaç Sanayi Ve Ticaret Ltd. Şti
| Geri Ödeme Kodu | A14823 |
| Satış Fiyatı | 202.49 TL [ 3 May 2024 ] |
| Önceki Satış Fiyatı | 202.49 TL [ 26 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699844521080 |
| Etkin Madde | Ipratropium Bromur Monohidrat |
| ATC Kodu | R03BB01 |
| Birim Miktar | 500+2 |
| Birim Cinsi | MCG/ML |
| Ambalaj Miktarı | 20 |
| Solunum Sistemi > Diğer İnhalanlar (solukla içeri çekilen ilaçlar) > İpratropium Bromür |
| Yerli ve Beşeri bir ilaçdır. |