FENTANEST 100mcg/2ml IV enjeksiyonluk çözelti (10 ampül) Kısa Ürün Bilgisi
{ Fentanil }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
FENTANEST 100 mcg /2 mL IV enjeksiyonluk çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her 1 mL solüsyon 50 mcg fentanile eşdeğer 78,5 mcg fentanil sitrat içerir.Yardımcı maddeler
Her bir mL çözelti 9 mg sodyum klorür içerir. Yardımcı maddeler için 6.1' e bakınız.
3. FARMASÖTİK FORMU
İntravenöz enjeksiyon için solüsyon içeren ampul. Steril, koruyucu içermeyen, izotonik, şeffaf çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
FENTANEST aşağıdaki durumlarda endikedir:
Genel ya da rejyonal anestezide narkotik analjezik katkısı olarak,
4.2. Pozoloji ve uygulama şekli
FENTANEST, yalnızca hava yolunun kontrol edilebildiği bir ortamda ve hava yolunu
kontrol edebilen bir personel tarafından uygulanmalıdır (Bkz. Bölüm 4.4).
Bradikardi oluşmasını önlemek için, indüksiyondan hemen önce düşük bir dozda intravenöz antikolinerjik uygulanması önerilmektedir.
Ampulü açarken eldiven giyilmesi önerilir (Bkz. Bölüm 6.6).
Pozoloji
FENTANEST dozu yaşa, vücut ağırlığına, fiziksel duruma, altta yatan patolojik koşullara, diğer ilaçların kullanımına, cerrahinin tipine ve anesteziye göre bireyselleştirilmelidir.
Yaşlı (>65 yaş) ve güçten düşmüş hastalarda başlangıç dozu azaltılmalıdır. Tamamlayıcı (ek) dozlar belirlenirken başlangıçdozununetkisi gözönünde bulundurulmalıdır.
Genel anestezide analjezik destek olarak kullanımı Düşük doz: 2 mikrogram/kg
Düşük dozlardaki FENTANEST daha çok, küçük ancak ağrılı cerrahi uygulamalarda yararlıdır.
Orta düzey doz: 2-20 mikrogram/kg
Cerrahi uygulama daha komplike olduğunda daha yüksek dozlar gerekebilir. Etki süresi doza bağlıdır.
Yüksek doz: 20-50 mikrogram/kg
Daha uzun süren ve stres yanıtının hastanın iyi olma haline zarar verebileceği büyük cerrahi uygulamalarda nitröz oksit/oksijen ile birlikte 20-50 mikrogram/kg FENTANEST' in hafifletici etkisi olduğu gösterilmiştir. Cerrahi operasyon sırasında bu aralıktaki dozlar kullanıldığında, uzamış postÂoperatif solunum depresyonu olasılığı göz önüne alınarak post-operatif ventilasyon ve izleme şarttır.
Hastanın gereksinimleri ve operasyonun tamamlanması için gerektiği tahmin edilen süreye
göre 25- 250 mikrogram/kg' lık (0,5-5 mL) ek dozlar uygulanabilir.
![]()
Anestezik ajan olarak kullanımı
Cerrahi strese yanıtın hafifletilmesi özellikle önemli olduğunda, oksijen ve kas gevşetici ile birlikte 50-100 mikrogram/kg' lık dozlar uygulanabilir. Bu teknik ek anestezik ajanlar kullanımına gerek kalmaksızın anestezi sağlar. Belirli olgularda bu anestezik etkinin sağlanması için 150 mikrogram/kg ' a kadar dozlar gerekebilir. FENTANEST bu biçimde miyokardın aşırı oksijen gereksiniminden korunması gereken hastalardaki açık kalp cerrahisi ve belirli başka majör cerrahi prosedürlerde özellikle kullanılmıştır.
Uygulama şekli:
İntravenöz enjeksiyon yolu ile uygulanır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek ve karaciğer fonksiyonlarında bozukluk olan hastalarda opioidler dikkatle titre edilmelidir. Böbrek yetmezliği olan hastalarda FENTANEST' in düşük dozlarının kullanımı değerlendirilmelidir ve bu hastalar fentanil toksisitesi belirtileri açısından dikkatle gözlemlenmelidir (Bkz. Bölüm 5.2).
Obez hastalar:
Doz vücut ağırlığına göre belirlenirse obez hastalarda yüksek doz verilmesi riski mevcuttur. Obez hastalarda doz tahmini yağsız vücut ağırlıklarına göre hesaplanmalıdır.
Pediatrik popülasyon:
2-11 yaşlarındaki çocuklarda indüksiyon ve idame için 2-3 mikrogram/kg doz önerilir. Çocuklarda doz rejimi genelde aşağıdaki gibidir:
| Yaş | Başlangıç | Destek |
Doğal Solunum | 2-11 yaş | 1-3 mikrogram/kg | 1-1,25 mikrogram/kg |
Destekli Solunum | 2-11 yaş | 1-3 mikrogram/kg | 1-1,25 mikrogram/kg |
12-17 yaşlarındaki çocuklarda yetişkin dozları uygulanabilir.
Geriatrik popülasyon:
Diğer opioidlerde olduğu gibi, yaşlı (>65 yaş) ya da düşkün kişilerde başlangıç dozu azaltılmalıdır. İdame dozlarının belirlenmesinde başlangıç dozunun etkisi dikkate alınmalıdır.
4.3. Kontrendikasyonlar
İlacın etkin maddesine ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık,
4.4. Özel kullanım uyarıları ve önlemleri
Tolerans gelişimi ve bağımlılık oluşabilir. FENTANEST' in intravenöz uygulanmasını takiben, özellikle hipovolemik hastalarda kan basıncında geçici bir düşme gelişebilir. Stabil bir arteriyel basıncın korunması için uygun önlemlerin alınması gerekir.
Solunum depresyonu
Diğer potansiyel opioidlerde olduğu gibi, derin analjeziye post-operatif periyotta da kalıcı olabilen ya da nüksedebilen belirgin solunum depresyonu eşlik edebilir. FENTANEST, yüksek dozlarda veya infüzyon ile uygulandığında anestezi sonrası bakım/derlenme odasından çıkış yapılmadan önce yeterli doğal solunumun oluşturulmuş ve sürekliliğinin sağlanmış olduğundan emin olunması zorunludur.
200 mikrogramdan yüksek dozlarda FENTANEST uygulanması sonrası ciddi bir solunum depresyonu oluşabilir. FENTANEST' in bu ve diğer farmakolojik etkileri spesifik opioid antagonistleriilegeridöndürülebilir.Solunum depresyonunun opioid
Resüsitasyon ekipmanı ve opioid antagonistler hazır bulundurulmalıdır. Anestezi sırasında hiperventilasyon, hastanın CO' ye yanıtını değiştirebilir, bu da post-operatif solunumu etkiler.
Doğum sırasında FENTANEST uygulanması neonatal solunum depresyonuna neden olabilir.
Kardiyak hastalık
Yeterli miktarda antikolinerjik almayan hastalarda ya da FENTANEST' in vagolitik olmayan kas gevşeticilerle kombine edildiği durumlarda bradikardi ve muhtemelen kardiyak arrest ortaya çıkabilir. Bradikardi atropin ile antagonize edilebilir.
Kas rijiditesi
Kas rijiditesi (morfin benzeri etki) ortaya çıkabilir.
Torakal kasları da kapsayan kas rijiditesinden aşağıdaki önlemlerle kaçınılabilir:
Yavaş intravenöz enjeksiyon (düşük dozlarda genellikle yeterlidir),
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer ilaçların FENTANEST üzerindeki etkisi:
Opioid premedikasyon, barbitüratlar, benzodiazepinler, nöroleptikler, halojenik gazlar ve diğer non-selektif merkezi sinir sistemi (MSS) depresanlarının (örn. alkol) kullanımı FENTANEST' in neden olduğu solunum depresyonunu güçlendirebilir veya uzatabilir.
Hastalar diğer MSS depresanlarını aldıklarında ihtiyaç duyulan FENTANEST dozu normalden az olacaktır.
FENTANEST klerensi yüksek olan bir ilaçtır ve çoğunlukla sitokrom P4503A4 (CY P3A4) tarafından büyük ölçüde ve hızla metabolize edilir.
Dört gün süreyle oral yolla verilen 200 mg/gün dozunda itrakonazolün (güçlü bir CYP3A4 inhibitörü) intravenöz FENTANEST' in farmakokinetiği üzerinde belirgin bir etkisi olmamıştır.
Oral ritonavir (en güçlü CYP3A4 inhibitörlerinden biri) intravenöz fentanilin klerensini üçte iki oranında azaltmıştır; ancak tek doz intravenöz fentanil uygulanmasının ardından elde edilen maksimum plazma konsantrasyonu etkilenmemiştir.
Flukonazol veya vorikonazolün (orta güçte CYP3A4 inhibitörleri) FENTANEST ile birlikte uygulanması, FENTANEST' e maruziyette artışla sonuçlanabilir. FENTANEST tek doz olarak kullanıldığında, ritonavir gibi güçlü CYP3A4 inhibitörlerinin birlikte kullanımı özel hasta bakımı ve izlenmesini gerektirir.
FENTANEST ile CYP3A4 inhibitörlerinin bir arada kullanıldığı sürekli tedavilerde, uzun süreli ya da gecikmiş solunum depresyonuna neden olabilecek FENTANEST birikiminden kaçınmak üzere doz azaltımı gerekebilir.
FENTANEST' in vagolitik olmayan kas gevşeticiler ile kombine kullanımı bradikardiye ve muhtemelen kalp durmasına neden olabilir.
FENTANEST' in droperidol ile eş zamanlı kullanımı daha yüksek hipotansiyon insidansına neden olabilir.
Serotonerjik ilaçlar:
Selektif Serotonin Geri-alım İnhibitörleri (SSRI) ve Serotonin Norepinefrin Geri-Alım İnhibitörleri (SNRI) gibi serotonerjik ilaçlarla ve serotonin metabolizmasını azaltan (Monoamin Oksidaz İnhibitörleri [MAOİ] dahil) ilaçlar ile birlikte kullanıldıklarında yaşamı tehdit etme riski bulunan serotonin sendromu gelişebilir.
FENTANEST' in diğer ilaçlar üzerindeki etkisi:
FENTANEST uygulanmasını takiben uygulanacak diğer merkezi sinir sistemi depresanı ilaçların dozu azaltılmalıdır.
FENTANEST ile birlikte kullanıldığında etomidatın plazma konsantrasyonu önemli ölçüde (2-3 kat) artmıştır. FENTANEST ile birlikte alındığında etomidatın yarılanma ömründe bir değişiklik olmaksızın, total plazma klerensi ve dağılım hacmi belirgin olarak (2 ila 3 kat kadar) azalmaktadır.
FENTANEST ile birlikte uygulanan intravenöz midazolamın terminal yarılanma ömrü uzamakta ve plazma klerensiazalmaktadır.Builaçların FENTANEST ile birlikte
kullanılmaları durumunda, dozlarının azaltılması gerekebilir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonlara ilişkin etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Genel tavsiye
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü(Kontrasepsiyon)
FENTANEST kullanımı gereken dönemde, gerekiyorsa, uygun bir kontrasepsiyon yöntemi kullanarak gebelikten korunulmalıdır.
Gebelik dönemi
FENTANEST' in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. FENTANEST gebeliğin erkendönemlerinde plasentadan geçebilir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
FENTANEST' in plasentaya geçmesi ve yenidoğan döneminde doğal solunumu baskılayabileceğinden doğum sırasında (sezaryen da dahil olmak üzere) uygulanması önerilmez (intramüsküler ya da intravenöz). FENTANEST kullanılacaksa, desteklenmiş solunum ekipmanı hem anne hem de bebek için gerekli olduğunda kullanılmak üzere hazır bulundurulmalıdır. Her zaman çocuk için bir antidot bulundurulmalıdır.
Laktasyon dönemi
Fentanil anne sütüne geçmektedir. Bu nedenle ilacın uygulamasından sonraki 24 saat içinde emzirme ve sağılmış anne sütü kullanımı önerilmemektedir. FENTANEST uygulamasını takiben emzirmenin risk/fayda oranı dikkate alınmalıdır.
Üreme yeteneği/Fertilite
Fentanilin kadın ve erkek fertilitesi üzerindeki etkileri hakkında klinik veri bulunmamaktadır. Hayvan çalışmalarında, sıçanlarla yapılan bazı testler maternal toksik dozlarda dişi fertilitesinde azalma göstermiştir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
kullanmamaları ve dikkat gerektiren bir iş yapmamaları konusunda uyarılmalıdır.
Bu ilaç kognitif fonksiyonları bozabilir ve hastanın güvenli araç kullanım yeteneğini
etkileyebilir.
Bu ilaç reçetelenirken hastalara aşağıdakiler söylenmelidir:
İlaç araç kullanma yeteneğinizi etkileyebilir,
İlacın sizi nasıl etkileyeceğini öğrenmeden araç kullanmayınız,
Bu ilacın etkisi altındayken araç kullanmanız trafik suçudur,
Ancak eğer aşağıdakiler sizin için geçerliyse bu bilerek suç işlemeye girmez:
ïBu ilaç tıbbi bir hastalığınızın tedavisi ya da diş tedaviniz için yazılmışsa,
ïİlacı reçeteleyen doktorun size söylediği gibi ve bu ilacın kullanım talimatında söylendiği gibi alıyorsanız,
ïSizin güvenli araç kullanım yeteneğinizi etkilemiyorsa.
4.8. İstenmeyen etkiler
Klinik çalışma verileri
I.V. fentanilin güvenliliği ile ilgili veriler, I.V. fentanilin anestezik bir ajan olarak kullanıldığı 20 klinik çalışmaya katılan 376 hastadan elde edilmiştir. Bu hastalar en az bir doz I.V. fentanil almışlar ve güvenlilik bilgisi sağlamışlardır.
Bu klinik çalışmalarda en sık bildirilen (görülme sıklığı %5 ve daha fazla) advers ilaç reaksiyonları şunlar olmuştur: bulantı (%26,1), kusma (%18,6), kas rijiditesi (%10 ,4),
hipotansiyon (%8,8), hipertansiyon (%8,8), bradikardi (%6,1) ve sedasyon (%5,3).
Yukarıdakiler dahil klinik çalışmalarda ya da pazarlama sonrası deneyimde bildirilen advers ilaç reaksiyonları aşağıda sıralanmıştır:
Advers ilaç reaksiyonları, sistem organ sınıfı ve sıklığına (SOC) göre listelenmektedir: Çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10), yaygın olmayan (≥1/ 1.000 ila <1/100),
seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları
Bilinmiyor: Hipersensitivite (anafilaktik şok, anafilaktik reaksiyon ve ürtiker gibi)
Psikiyatrik hastalıklar
Yaygın: Ajitasyon
Yaygın olmayan: Öforik durum
Sinir sistemi hastalıkları
Çok yaygın: Kas rijiditesi (torasik kasları da içeren)
Yaygın olmayan: Başağrısı
Bilinmiyor: Konvülsiyonlar, bilinç kaybı, miyoklonus
Göz hastalıkları
Yaygın: Görsel bozukluklar
Kardiyak hastalıklar
Yaygın: Bradikardi, taşikardi, aritmi
Bilinmiyor: Kardiyak arrest
Vaskülerhastalıklar
Yaygın: Hipotansiyon, hipertansiyon, venöz ağrı Yaygın olmayan: Filebit, kan basıncında oynamalar
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Yaygın: Laringospazm, bronkospazm, apne Yaygın olmayan: Hiperventilasyon, hıçkırıklar Bilinmiyor: Solunum depresyonu
Gastrointestinal hastalıklar
Çok yaygın: Bulantı, kusma
Deri ve deri altı doku hastalıkları Yaygın: Alerjik dermatit Bilinmiyor: Kaşıntı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın olmayan: Üşüme, hipotermi
Cerrahi ve tıbbi prosedürler
Yaygın: Post-operatif konfüzyon
Yaygın olmayan: Anestezinin solunum yolu komplikasyonu
Bir nöroleptik FENTANEST ile birlikte kullanıldığında aşağıdaki advers reaksiyonlar gözlenebilir: ürperme ve/veya titreme, huzursuzluk, post-operatif halüsinasyon epizodları ve ekstrapiramidal semptomlar (Bkz. Bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)' ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35
99).
4.9. Doz aşımı ve tedavisi
Belirti ve işaretler:
FENTANEST' in doz aşımı belirtileri genelde farmakolojik etkilerinin artması şeklindedir. Bireysel hassasiyete bağlı olarak klinik tablo öncelikle solunum depresyonunun bradipneden apneye kadar değişen dereceleri ile tanımlanır.
Tedavi:
Hipoventilasyon ya da apne oluşması halinde:
Oksijen uygulanmalı ve gereken biçimde solunuma yardımcı olunmalı ya da kontrol edilmelidir.
Solunum depresyonu halinde:
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: OpioidAnestezikler
ATC Kodu: N01AH01
Genel Özellikler
Fentanil, morfinden 50 ila 100 kat güçlü sentetik bir opioiddir.
Etkisi hızlı başlar ve etki süresi kısadır. İnsanlarda, 0.5-1 mg/70 kg' lık tek bir I.V. dozu ile cerrahi analjezi, solunum depresyonu, bradikardi ve diğer tipik morfin benzeri etkiler hızlıca gelişir. En yüksek etki süresi yaklaşık 30 dakikadır. Tüm güçlü morfin benzeri ilaçlar ağrıda rahatlama, solunum depresyonu, bulantı, kabızlık, fiziksel bağımlılık, bazı vagus etkiler ve değişen derecelerde sedasyon geliştirirler. Fentanil, sadece kısa etki süresine göre değil, aynı zamanda hayvanlarda kusma etkisinin olmaması ve minimal hipotansif faaliyet ile de morfinden farklılık gösterir.
Fentanilin tüm etkileri spesifik bir narkotik antagonisti ile hızla ve tamamen geri döndürülebilir.
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
İntravenöz uygulama yolu nedeniyle gastrointestinal emilim söz konusu değildir.
Dağılım:
İntravenöz enjeksiyondan soma fentanilin plazma konsantrasyonları hızla düşer, ardışık dağılım yarılanma ömürleri yaklaşık l dakika ve 18 dakikadır, terminal eliminasyon yarılanma ömrü ise 475 dakikadır. Fentanilin V' si (santral kompartman dağılım hacmi) 13 L ve toplam V' si (kararlı durumdaki dağılım hacmi) 339 L' dir. Fentanilin plazma proteinlerine bağlanma oranı yaklaşık %84' tür.
![]()
Biyotransformasyon:
Fentanil başlıca karaciğerde CYP3A4 enzimiyle hızla metabolize edilir. Başlıca metaboliti norfentanildir. Fentanilin klerensi 574 mL/dakikadır.
Eliminasyon:
Uygulanan dozun yaklaşık %75'i 24 saat içinde atılır ve yalnızca %10' u değişmemiş ilaç olarak idrarla atılmaktadır.
Hastalardaki karakteristik özellikler
Çocuklar:
Fentanilin yeni doğan bebeklerdeki plazma proteinlerine bağlanma oranı yaklaşık %62'dir ve erişkinlerdekinden düşüktür. Süt çocukları ve çocuklarda klerens ve dağılım hacmi daha yüksektir. Bu durum, fentanil için daha fazla doz gereksinimine neden olabilir.
![]()
Yanığı olan erişkin hastalar:
Fentanilin klerensinde olan %44'e varan bir artışla beraber daha geniş bir dağılım hacmi, ilacın plazma konsantrasyonlarında azalmayla sonuçlanır. Bu durum fentanil dozunun arttırılmasını gerektirebilir.
Böbrek yetmezliği:
Böbrek transplantlı hastalarda intravenöz fentanil kullanılan bir çalışmadan elde edilen veriler, bu hasta popülasyonunda klerensin azalabileceğini öngörmektedir. Böbrek yetmezliği olan hastalar fentanil kullanacaksa, fentanil toksisitesi belirtileri açısından dikkatle gözlemlenmelidir ve gerekli ise doz azaltılmalıdır (Bkz. Bölüm 4.2).
Obez hastalar:
Artmış vücut kütlesi ile fentanil klerensinde artış görülmüştür. Vücut Kitle İndeksi 30' dan yüksek olan hastalarda, fentanil klerensi her 10 kg yağsız vücut kütlesi artışıyla yaklaşık olarak % l0 artmaktadır.
·
5.3. Klinik öncesi güvenlilik verileri
Diğer opioid analjeziklerle olduğu gibi, in vitro fentanil, memeli hücre kültürü deneyinde yalnızca sitotoksik konsantrasyonlarda ve metabolik aktivasyonla birlikte mutajenik etkiler göstermiştir. İn vivo kemirgen deneylerinde ve bakteriyel çalışmalarda fentanil mutajenite belirtisi göstermemiştir.
Sıçanlarda gerçekleştirilen iki yıllık çalışmada fentanil karsinojenik bulunmamıştır. Dişi sıçanlarda yapılan bazı testler, fertilite azalması ve embriyo mortalitesi göstermiştir. Bu bulgular, maternal toksisite ile ilişkilidirler ve ilacın gelişmekte olan embriyo üzerine doğrudan etkisi ile ilişkili değildir. Teratojenik etkilere dair bulgu yoktur.
6. FARMASÖTİK ÖZELLİKLER
Yardımcı maddeler
Her bir mL çözelti 9 mg sodyum klorür içerir. Yardımcı maddeler için 6.1' e bakınız.
Sodyum Klorür
Enjeksiyonluk Su
6.2. Geçimsizlikler
Bu tıbbi ürün diğer ürünlerle karıştırılmamalıdır.
FENTANEST %0,9 NaCl ve %5 Dekstroz çözeltisi ile seyreltildiğinde 2-8°C' de 24 saat stabildir.
6.3. Raf ömrü
60 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklanmalıdır.
Işıktan korumak için ampullerorijinaldışkartonuiçindesaklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Her biri 2 mL çözelti içeren 2 mL kapasiteli 10 adet Tip 1, renksiz cam ampul içeren
kutularda kullanıma sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliği' ve âAmbalaj Atıklarının Kontrolü Yönetmelikleri' ne uygun olarak imha edilmelidir.
Uygulama şekli:
FENTANEST dozu yaşa, vücut ağırlığına, fiziksel duruma, altta yatan patolojik koşullara, diğer ilaçların kullanımına, cerrahinin tipine ve anesteziye göre bireyselleştirilmelidir.
Yaşlı (>65 yaş) ve güçten düşmüş hastalarda başlangıç dozu azaltılmalıdır. Tamamlayıcı (ek) dozlar belirlenirken başlangıç dozunun etkisi göz önünde bulundurulmalıdır.
Kullanımda dikkat edilmesi gereken noktalar
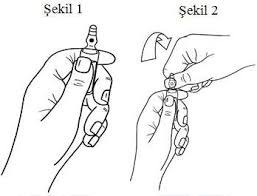
Ampulü baş ve işaret parmakları arasında tutunuz, ampulün ucunu serbest bırakınız.
Diğer elle ampulün ucunu, işaret parmağını ampulün boynuna ve baş parmak renkli çizgilere paralel olarak renkli noktanın üzerine gelecek şekilde tutunuz.
Baş parmağı noktanın üzerinde tutarak ampulün ucunu hızla kırınız, bu sırada ampulün gövdesini diğer elle tutunuz.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ACTIQ | 8699804060109 | |
| DUROGESIC | 8699593815041 | 849.84TL |
| EFFENTORA | 8699638065530 | 577.66TL |
| FENTANEST | 8681281000174 | |
| FENTANYL | 8699548750557 | |
| Diğer Eşdeğer İlaçlar |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
İLAÇ GENEL BİLGİLERİ
Türkem İlaç
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8681281000174 |
| Etkin Madde | Fentanil |
| ATC Kodu | N01AH01 |
| Birim Miktar | 0.1 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 10 |
| Sinir Sistemi > Genel Anestezikler > Fentanil |
| İthal ( ref. ülke : Turkiye ) ve Beşeri bir ilaçdır. |