EXTRANEFROL PERITON diyaliz çözeltisi (2500 ml TEK torba) Kısa Ürün Bilgisi
{ Peritonal Diyaliz Solüsyonu }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
EXTRANEFROL periton diyaliz çözeltisi Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
si:Her 100 mL'lik çözelti:
â İkodekstrin: 7,5 g
â Sodyum Klorür: 0,54 g
â Sodyum Laktat: 0,45 g
â Kalsiyum Klorür Dihidrat: 0,0257 g
â Magnezyum Klorür Hekzahidrat: 0,0051 g içerir.
Yardımcı maddeler
Sodyum hidroksit k.m
Diğer yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Periton diyalizi çözeltisi.
Steril, berrak çözelti.
Elektrolit Konsantrasyonları:
Sodyum: 132,6 mmol/litre, 132,6 mEq/litre
Kalsiyum: 1,75 mmol/litre, 3,5 mEq/litre
Magnezyum: 0,25 mmol/litre, 0,5 mEq/litre
Klorür: 96,4 mmol/litre, 96,4 mEq/litre
Laktat: 40,2 mmol/litre, 40,2 mEq/litre
pH: 5 - 6
Osmolarite: 282 - 284 mOsm/litre
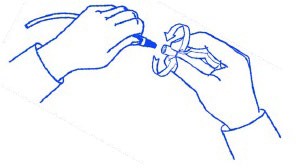
Mini kapağı ambalajından alınız.
Ara setin uç kısmını aşağıya doğru pozisyonda tutunuz. Mini kapağı dikkatlice kavrayıp elinizle saat yönünde sıkarak iyice sabitlenene kadar ara seti üzerine (Şekle bakınız) derhal yerleştiriniz. Not: Mini kapağı çok sıkmayınız.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
EXTRANEFROL, kronik böbrek yetmezliği tedavisinde özellikle glukoz solüsyonlarında ultrafiltrasyonu kaybetmiş hastalar için sürekli ayaktan periton diyaliz (SAPD) veya aletli periton diyaliz (APD) rejiminin bir parçası olarak tek bir glukoz değişimi için günde bir kez önerilir. Çünkü bu tür hastalarda SAPD tedavisinde kalabilme süresini uzatabilir.
4.2. Pozoloji ve uygulama şekli
Pozoloji / Uygulama sıklığı ve süresi:EXTRANEFROL'ün, uzun bekleme süresi boyunca, yani genellikle sürekli ayaktan periton diyalizinde (SAPD) gece boyunca ve otomatik (aletli) periton diyalizinde (APD) uzun gündüz vakti kullanılması önerilir.
Tedavi şekli, tedavi sıklığı, değişim hacmi, bekleme süresi ve diyaliz süresi hekim tarafından başlatılmalı ve denetlenmelidir.
Uygulama şekli:
Yetişkinler:
- Sürekli ayaktan periton diyalizi (SAPD) veya otomatik (aletli) periton diyalizi (APD) rejiminin bir parçası olarak, her 24 saatlik periyotta tek bir değişimle sınırlı intraperitoneal uygulama yapılır.
Uygulanacak hacim, hasta için uygun olan bir hızda yaklaşık 10-20 dakika süreyle verilmelidir. Normal vücut ağırlığındaki yetişkin hastalar için, dolum hacmi 2 L'yi aşmamalıdır. Vücut ağırlığı daha fazla olan hastalar (70-75 kg'dan fazla) için 2,5 L'lik bir dolum hacmi kullanılabilir.
Eğer verilen hacim karın gerginliği nedeniyle rahatsızlık verirse, verilen hacim azaltılmalıdır. Önerilen kalma süresi sürekli ayaktan periton diyalizinde 6 ila 12 saat, otomatik (aletli) periton diyalizinde (APD) 14 ila 16 saat arasındadır. Sıvının drenajı, hasta için uygun olan bir oranda yerçekimi yardımıyla yapılır.
Uygulama öncesinde dikkat edilmesi gereken parametreler
EXTRANEFROL yalnızca periton içine uygulama içindir. İntravenöz yoldan
uygulanmaz.
4.3. Kontrendikasyonlar
EXTRANEFROL, aşağıdaki durumlarda kontrendikedir:
Etkin madde
si:4.4. Özel kullanım uyarıları ve önlemleri
EXTRANEFROL kullanımı, bazı test kitleriyle yapılan kan şekeri ölçümlerinin sonuçlarını etkileyebilir.
Maltoz etkileşimini önlemek için kan şekeri ölçümü, glukoz spesifik yöntemlerle yapılmalıdır. Glukoz de-hidrogenaz pirolokinolinkinon (GDH-PQQ) veya glukoz dye- oksidoredüktaz (GDO) bazlı yöntemler kullanılmamalıdır.
Yanlış olarak yüksek bulunan şeker seviyeleri, hastadaki gerçek kan şekeri düşüklüğünü de (hipoglisemi) maskeleyebilir ve benzer sonuçlara yol açacak şekilde tedavisiz kalmasına neden olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
EXTRANEFROL'ün diğer tıbbi ürünlerle etkileşimini araştıran bir çalışma yapılmamıştır. Periton diyaliziyle, diyalizle uzaklaştırılabilen bazı ilaçların kan konsantrasyonları azalabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Çocuk hastalarda güvenirlik ve etkinliği gösterilmediğinden kullanılmaz. Herhangi bir etkileşim çalışması yapılmamıştır.
Laboratuvar testleriyle etkileşimler:
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)
EXTRANEFROL'ün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
EXTRANEFROL, gebelik esnasında ve çocuk doğurma potansiyeli olan ve doğum kontrolü kullanmayan kadınlarda önerilmemektedir.
Gebelik dönemi
Gebe kadınlarda EXTRANEFROL kullanımı ile ilgili deneyimler yeterli değildir. EXTRANEFROL hamilelik sırasında önerilmez.
Hayvanlar üzerinde yapılan araştırmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve-
veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz.
Laktasyon dönemi
EXTRANEFROL metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Yenidoğan ve bebeklerdeki riski göz ardı edilemez.
Laktasyon dönemindeki kadınlarda EXTRANEFROL kullanımı ile ilgili deneyimler yeterli değildir. Hekimler EXTRANEFROL reçetelemeden önce her bir hasta için tedavinin potansiyel riskleriyle olası yararını dikkatle göz önünde bulundurmalıdır.
Üreme yeteneği / Fertilite
EXTRANEFROL'ün üreme yeteneğine etkisine ilişkin yeterli veri mevcut değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
- Periton diyaliziyle tedavi edilen Son Dönem Böbrek Yetmezliği (SDBY) hastalarında araç ve makina kullanımını etkileyebilecek istenmeyen etkiler görülebilir.
4.8. İstenmeyen etkiler
Klinik çalışmalarda EXTRANEFROL ile tedavi edilen hastalarda aşağıdaki istenmeyen etkilerin görüldüğü gösterilmiştir.
Döküntü ve kaşıntı dahil olmak üzere EXTRANEFROL ile ilişkili cilt reaksiyonları, genellikle şiddetli veya orta derecelidir. Bazen bu döküntüler eksfoliyasyon ile ilişkilendirilmiştir. Bu durumun meydana gelmesi durumunda ve ciddiyetine bağlı olarak, EXTRANEFROL'ün en azından geçici olarak kullanımı durdurulmalıdır. geri çekilmelidir.
Not: Görülme sıklığı, izleyen kriterler kullanılarak değerlendirilmiştir: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila
<1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir gruptaki sıralamada istenmeyen etkiler en ciddi olandan daha az ciddi olana doğru sıralanmıştır.
Sistem Organ Sınıflaması | 4.8. İstenmeyen etkiler | Sıklığı* |
Enfeksiyon ve enfestasyonlar | Grip sendromu Fronkül | Yaygın olmayan Yaygın olmayan |
Kan ve lenfatik sistemi hastalıkları | Anemi Lökositoz Eozinofili Trombositopeni Lökopeni | Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor Bilinmiyor |
Bağışıklık sistemi hastalıkları | Vaskülit Hipersensitivite** | Bilinmiyor Bilinmiyor |
Metabolizma ve beslenme hastalıkları | Dehidrasyon Hipovolemi Hipoglisemi Hiponatremi Hiperglisemi Hipervolemi Anoreksi Hipokloremi Hipomagnezemi Hipoproteinemi Şok hipoglisemi Sıvı dengesizliği | Yaygın Yaygın Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor Bilinmiyor |
Psikiyatrik hastalıkları | Anormal düşünce Anksiyete Sinirlilik | Yaygın olmayan Yaygın olmayan Yaygın olmayan |
Sinir Sistemi hastalıkları | Sersemlik hali Başağrısı Hiperkinezi Parestezi Aguzi Hipoglisemik koma Yanma hissi | Yaygın Yaygın Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor Bilinmiyor |
Göz hastalıkları | Bulanık görme | Bilinmiyor |
Kulak ve iç kulak hastalıkları | Çınlama | Yaygın |
Kalp hastalıkları | Kardiyovasküler bozukluk Taşikardi | Yaygın olmayan
Yaygın olmayan |
Vasküler bozukluklar | Hipotansiyon Hipertansiyon Ortostatik hipotansiyon | Yaygın Yaygın Yaygın olmayan |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları | Pulmoner ödem Dispne Öksürük Hıçkırık Bronkospazm | Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor |
Gastrointestinal hastalıkları
| Karın ağrısı Bağırsak tıkanıklığı Peritonit Kanlı peritoneal sıvı Diyare Gastrik ülser Gastrit Kusma Kabızlık Dispepsi Bulantı Ağızda kuruluk | Yaygın Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan resi:https://www.turkiye.gov.tr/saglik |
| Assit Kasık fıtığı Abdominal rahatsızlık | Bilinmiyor Bilinmiyor Bilinmiyor |
Deri ve deri altı doku hastalıkları | Döküntü (maküler, papüler, eritematöz dahil) Kaşıntı Deri eksfoliasyonu Ürtiker Büllöz dermatit Psoriazis Deri ülseri Ekzema Tırnak hastalığı Deride kuruma Deride renk değişikliği Toksik epidermal nekroliz Eritema multiforme Anjioödem Genel ürtiker Toksik deri döküntüsü Periorbital ödem Dermatit (alerjik ve kontakt dermatit dahil) Kızarıklık Blister (kabarcık) | Yaygın
Yaygın Yaygın Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor
Bilinmiyor Bilinmiyor Bilinmiyor Bilinmiyor Bilinmiyor Bilinmiyor
Bilinmiyor Bilinmiyor |
Kas-iskelet sistemi bozuklukları, bağ doku ve kemik hastalıkları | Kemik ağrısı Kas spazmı Miyalji Boyun ağrısı Artralji Sırt ağrısı Kas-iskelet ağrısı | Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor Bilinmiyor Bilinmiyor |
Böbrek Ve İdrar Yolu hastalıkları | Böbrek ağrısı | Yaygın olmayan |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
| Periferik ödem Asteni Göğüs ağrısı Yüzde ödem Ödem Ağrı Ateş Titreme Halsizlik Kateter bölgesinde kızarıklık Kateter bölgesinde inflamasyon | Yaygın Yaygın Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Bilinmiyor Bilinmiyor Bilinmiyor Bilinmiyor
Bilinmiyor
resi:https://www.turkiye.gov.tr/saglik |
| İnfüzyondan kaynaklı reaksiyon (infüzyon bölgesinde ağrı, instilasyon bölgesinde ağrı dahil) |
|
Araştırma Bulguları | Alanin amino transferaz artışı Aspartat amino transferaz artışı Kan alkalen fosfataz artışı Karaciğer fonksiyon testlerinde anormallik Kilo azalması Kilo artışı | Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan Yaygın olmayan |
Yaralanma ve zehirlenme | Cihaz etkileşimi* | Bilinmiyor |
* İkodekstrin kan şekeri ölçüm cihazlarına etki eder (Bkz. Bölüm 4.4).
** EXTRANEFROL kullanan hastalarda bronkospazm, hipotansiyon, döküntü, pruritus ve ürtiker dahil aşırı duyarlılık tipi reaksiyonlar bildirilmiştir.
Periton diyalizi ile ilgili diğer istenmeyen etkiler: fungal peritonit, bakteriyel peritonit, kateter bölgesi enfeksiyonu, kateterle ilişkili enfeksiyon ve kateterle ilişkili komplikasyon.
Artmış ultrafiltrasyon, özellikle yaşlı hastalarda, hipotansiyon, baş dönmesi ve muhtemelen nörolojik semptomlarla sonuçlanan dehidratasyona yol açabilir (Bkz. Bölüm 4.4).
Diyabetik hastalarda hipoglisemik ataklar (Bkz. Bölüm 4.4).
Serum alkalin fosfatazlarında (Bkz. Bölüm 4.4) ve elektrolit bozukluklarında artış (örn. Hipokalemi, hipokalsemi ve hiperkalsemi).
Karın ağrısı, bakteri içeren veya içermeyen bulanık atıklar ve aseptik peritonit dahil olmak üzere peritoneal reaksiyonlar (Bkz. Bölüm 4.4).
Yorgunluk genellikle spontane olarak raporlanmıştır; literatürde ise prosedürle ilgili istenmeyen bir etki olarak bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Doz aşımının etkilerine dair veri bulunmamaktadır.
EXTRANEFROL'ün uzun süreyle 24 saatte bir torbadan fazla uygulanması karbonhidrat metabolitleriyle maltozun plazma düzeylerinin artmasına neden olur. Böyle bir artışın etkisi bilinmemekle birlikte, plazma ozmolalitesinde bir artış oluşabilir.
EXTRANEFROL ile doz aşımı durumunda, tedaviye ikodekstrin içermeyen çözeltilerle yapılan periton diyalizi veya hemodiyaliz ile devam edilebilir.
4.3. Kontrendikasyonlar
İyoda karşı bilinen alerjik reaksiyon öyküsü varsa bu ürünü kullanmayınız. Daha fazla bilgi için doktorunuza başvurunuz.
Uyarılar
Aseptik teknik kullanınız. Sıvı yolunun herhangi bir kısmında kontaminasyon olması peritonit ile sonuçlanabilir.
Ambalajı daha önceden açılmış, hasar görmüş veya lekelenmişse ya da iç kısımda bulunan povidon-iyotlu sünger kuruysa kullanmayınız. Ürün kullanılmışsa atınız.
Oda sıcaklığında saklayınız. Aşırı ısıdan koruyunuz.
Bu ürün tek kullanımlıktır. Tek kullanımlık bir ürünün yeniden kullanılması veya yeniden işlemden geçirilmesi, kontaminasyona ve ürünün işlevinin veya yapısal bütünlüğünün zarar görmesine neden olabilir.
Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Kazara yutulması halinde, derhal doktorunuzadanışınız.
Küçük peritoneal diyalizat dolum hacmi olan hastalarda, özellikle bebek ve çocuklarda, tiroid fonksiyonunun izlenmesi tavsiye edilmektedir. İyot maruziyetini minimuma indirmek için, klinik olarak mümkün olduğunda, bir sonraki dolum döngüsünü başlatmadan önce periton boşluğundaki sıvıyı drenaj torbasına boşaltınız.
Diğer üreticilerden temin edilebilen pek çok diyaliz ürünü, Polifarma ekipmanı veya tek kullanımlık ürünleriyle birlikte kullanılmaktadır. Bu ürünlerdeki değişkenlik, toleranslar, mekanik kuvvet veya zaman zaman yapılabilecek değişiklikler Polifarma'nın kontrolü dışındadır. Bundan dolayı Polifarma, başka üreticilerin diyaliz ürünlerinin, kendi ürünleri ile kullanıldığında tatmin edici bir şekilde işleyeceğini garanti edemez.
Kullanım Talimatı
Dikkat: Aseptik teknik kullanınız.
Doktorunuz tarafından verilen talimatlara uyunuz. Bir yüz maskesi takınız. Ellerinizi dezenfektan özelliği olan sabun ile yıkayıp tamamen kurutunuz. Ellerinize antiseptik uygulayınız.
Ara setin uç kısmını aşağıya doğru pozisyonda tutunuz. Mini kapağı dikkatlice kavrayıp elinizle saat yönünde sıkarak iyice sabitlenene kadar ara seti üzerine (Şekle bakınız) derhal yerleştiriniz. Not: Mini kapağı çok sıkmayınız.

5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Peritoniyal diyaliz çözeltileri / İzotonik çözeltiler
ATC kodu: B05D
İkodekstrin, periton diyalizinde uzun beklemeli değişimlerde intraperitoneal olarak uygulandığında ozmotik ajan olarak etki eden nişasta bazlı bir glukoz polimeridir. % 7,5'lik bir solüsyon yaklaşık olarak serum ile izo-ozmolardır. Ancak SAPD'de 12 saate kadarlık bir süre boyunca sürekli bir ultrafiltrasyon sağlar. Hiperosmolar glukoz solüsyonlarına kıyasla hastaya yüklenen kalori miktarı daha azdır.
Üretilen ultrafiltrat hacmi, SAPD'de kullanıldığında % 3,86'lık glukoz ile karşılaştırılabilir. Kan glukozu ve insülin seviyeleri etkilenmeden kalır.
Ultrafiltrasyon, peritonit atakları sırasında sürdürülür.
Önerilen pozoloji, SAPD veya APD rejiminin bir parçası olarak, her 24 saatlik periyotta tek bir değişim ile sınırlıdır.
5.2. Farmakokinetik özellikler
Genel özelliklerKandaki karbonhidrat polimer düzeyleri, gecelik diyaliz için günlük olarak kullanıldığında yaklaşık 7-10 gün sonra kararlı duruma ulaşmaktadır. Polimer amilaz tarafından, peritoneal diyaliz yoluyla temizlenen daha küçük fragmanlara hidrolize olur. 9'dan büyük (G9) glukoz ünitesi oligomerleri için 1,8 mg/mL kararlı durum plazma düzeyleri ölçülmüştür ve aynı zamanda serum maltozda (G2) 1,1 mg/mL'ye bir artış olmuştur; diğer yandan, serum ozmolalitesinde anlamlı bir değişim yoktur. APD'de uzun süre karında kalma söz konusu olduğunda, 1,4 mg/mL maltoz düzeyleri ölçülmüştür; fakat serum ozmolalitesinde anlamlı bir değişiklik olmamıştır.
Maltoz ve glukoz polimerinin yükselmiş plazma düzeylerinin uzun süreli etkileri bilinmemektedir; fakat bunların zararlı olduğunu düşünmek için herhangi bir gerekçe bulunmamaktadır.
Emilim:
İkodekstrin periton zarından sıfır-derece kinetikle uyumlu olarak peritoneal lenfatik yollardan konektif transportla emilir. Periton diyalizi ile tedavi gören hastalarda gerçekleştirilen bir tek doz EXTRANEFROL farmakokinetik çalışmasında, 12 saatlik kalış süresi içinde uygulanan İkodekstrinin ortalama %40'ı (60 g) peritoneal çözeltiden emilmiştir. İkodekstrinin plazma düzeyleri bekleme süresinde yükselmiş ve çözelti drene edildikten sonra düşmüştür. Uzun bekleme süreli değişim sonunda (ortalama T= 13 saat) İkodekstrin ve metabolitlerinin pik plazma düzeyleri (ortalama C2,2 g/l) gözlenmiştir. Plazma düzeyleri İkodekstrin uygulanmasına son verildikten sonra yaklaşık iki haftada başlangıç düzeylerine dönmüştür.
Dağılım:
Bkz. biyotransformasyon. Biyotransformasyon:
İkodekstrin alfa amilaz aracılığıyla düşük düzeyde polimerizasyonla (DP) maltoz (DP2), maltotrioz (DP3) ve maltotetraoz (DP4) dahil oligosakkaritlere ve yüksek molekül ağırlıklı oligosakkaritlere metabolize olur. Yapılan bir tek doz çalışmasında DP2, DP3 ve DP4'ün plazma konsantrasyonları, bekleme süresi sonunda pik düzeylere ulaşılarak ve daha sonra düşerek toplam İkodekstrininkine benzer bir profilde ve progressif olarak yükselme göstermiştir. Maltoz, maltotrioz ve maltotetraozdan büyük oligosakkaritlerin kan düzeylerinde yalnızca hafif düzeyde yükselmeler gözlendi. İkodekstrinin periton içi metabolizması 12 saatlik bekleme süresi boyunca diyalizattaki küçük polimerlerin konsantrasyonundaki progressif yükselmenin öngördüğü şekilde oluşabilir. Bu metabolitlerin diyalizattaki düzeyleri kandaki düzeylerinden yüksek olduğundan, diyalizatta bulunma nedenleri kandan difüzyonlarından ziyade intraperitoneal metabolizmalarına bağlı olması muhtemeldir.
Bir hafta içinde İkodekstrin metabolitlerinin kararlı plazma düzeylerine ulaşılır ve uzun süreli uygulamada plazma düzeyleri sabit kalır.
Eliminasyon:
İkodekstrinin eliminasyonuna renal atılımın katkısı azdır (emilen miktarın <%1 ila yaklaşık
%8'i arasında) ve rezidüel renal fonksiyon düzeyiyle doğrusal orantısaldır. Daha küçük boyutlu İkodekstrin metabolitlerinin, özellikle DP2 ve DP3'ün peritoneal boşluğa eliminasyonu da mümkündür (diyaliz yoluyla).
Hastalardaki karekteristik özellikler
Yaş, cinsiyet ve ırksal özelliklerin İkodekstrin ve metabolitlerinin farmakokinetik özellikleri üzerindeki etkisi araştırılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Akut toksisite
Farelerde ve sıçanlarda yapılan akut i.v. ve i.p. çalışmalarda 2000 mg / kg'a kadar olan dozlarda hiçbir etki gösterilmemiştir.
Subkronik toksisite
Sıçanlara ve köpeklere 28 gün boyunca günde iki kez % 20 Ikodekstrin çözeltisinin i.p. yoldan uygulanması, hedef organ veya doku toksisitesine neden olmamıştır. En önemli etki, sıvı dengesinin dinamikleri üzerine olmuştur.
Mutajenik ve tümörijenik potansiyel
Mutajenite ile ilgili in vitro ve in vivo çalışmalar negatif sonuç vermiştir. Ürünle karsinojenisite çalışmaları mümkün değildir, ancak molekülün kimyasal yapısı, farmakolojik etkisi olmaması, hedef organ toksisitesinin olmayışı ve mutajenite çalışmalarındaki negatif sonuçlar göz önüne alındığında ürünün karsinojenik etkilerinin olması muhtemel değildir.
Üreme toksisitesi
Sıçanlarda yapılan üreme toksisitesi çalışması, ürünün fertilite veya embriyofetal gelişim üzerinde hiçbir etkisi olmadığını göstermemiştir.
Karsinojenez, Mutajenite, Fertilitede Bozulma
İkodekstrin, in vitro bakteriyel hücre revers mutasyon testinde (Ames testi), in vitro memeli hücresi kromozomal aberasyon testinde (CHO hücre testi) ve sıçanlarda in vivo mikronukleus testinde genotoksik potansiyel göstermemiştir. EXTRANEFROL ya da İkodekstrinin karsinojen potansiyelini araştırmak amacıyla uzun süreli hayvan çalışmaları yapılmamıştır. İkodekstrin, yaygın bir gıda suplemanı olan maltodekstrinden türetilmektedir.
İlacın sıçan ve farelere sırasıyla dört ve iki hafta süreyle uygulandığı bir fertilite çalışmasında, gebelik öncesi ve gebeliğin 17 gününe kadar günlük 1,5 g/kg'a kadar olan dozlarla (mg/m bazında insanlarda maruz kalınan dozun 1/3'ü) yüksek dozlama yapılan grupta kontrole kıyasla parental erkeklerde hafifçe düşük epididimal ağırlıklar belirlenmiştir. Başka bir üreme organı etkilenmediğinden ve tüm erkeklerde kanıtlanmış fertilite olduğundan bu bulgunun toksikolojik önemi bilinmemektedir. Çalışma İkodekstrinle tedavinin çiftleşme performansı, fertilite, doğum yanıtı, embryo-fetal sürvi ya da fötal büyüme ve gelişme üzerinde herhangi bir etkisinin olmadığını göstermiştir.
Değişim sırasında, Mini kapağı saat yönünün tersine çevirerek ara seti bağlantısından çıkarınız.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum hidroksit (pH ayarı için) Hidroklorik asit (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
Eczacıya danışılmalıdır. Hekim tarafından ilaç eklemesi gerekli bulunulmuşsa, işlem aseptik
teknikle yapılmalıdır.
Ek ilaçlar hakkında tam bilgi almak amacıyla eklenen ilacın ürün bilgilerine bakılmalıdır. EXTRANEFROL ile bazı ilaçlar geçimsiz olabilir:
Potasyum eklenmesi
Diyaliz işleminin, hiperkalemiyi düzeltmek amacıyla yapılabilmesi nedeniyle EXTRANEFROL çözeltilerine potasyum eklenmemiştir. Normal serum potasyum düzeylerinin ya da hipokaleminin olduğu durumlarda şiddetli hipokalemiyi önlemek amacıyla, tedaviye potasyum klorür (4 mEq/litre ye kadar konsantrasyonlarda) eklemek gerekebilir. Potasyum klorür eklenmesi kararı serum potasyum düzeylerininin dikkatle değerlendirilmesinden sonra hekim tarafından verilmelidir.
6.3. Raf ömrü
24 ay.
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklanmalıdır. Berrak olmayan ve ambalajı bozulmuş çözeltiler kullanılmamalıdır. Dış ambalajından çıkarıldıktan sonra ürün hemen kullanılmalıdır.
6.5. Ambalajın niteliği ve içeriği
2000 mL ve 2500 mL'lik PVC torbalarda ambalajlandıktan sonra dış torbalara koyulur.
2000 mL ve 2500 mL Çiftli Torba (boşaltma torbalı) + Mini kapaklı
2000 mL ve 2500 mL Tekli Torba (boşaltma torbasız)
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Ürün tek kullanımlıktır; kullanımdan sonra torbada kalan çözelti atılmalıdır. Arta kalan maddelerin imhası için özel bir yöntem önerilmemektedir.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Uygulamayla ilgili diğer özel önlemler:
Yöntemin başından sonuna kadar aseptik teknik kullanılmalıdır. Uygulamadaki rahatsızlığı gidermek için uygulamadan hemen önce dış torbası içindeyken çözelti 37°C'ye kadar ısıtılabilir.
Isıtma işlemi kuru hava kullanılarak yapılmalıdır, ideal olanı bunun için yapılmış olan ısıtıcıları kullanmaktır. Konektörlerin kontaminasyonunu önlemek için suyun içinde ısıtılmamalıdır.
Ürün herhangi bir ilaç ilavesinden sonra hemen kullanılmalıdır.
Mini kapak (Povidon İyotlu):
Tanım
Bu ürün periton diyalizi tedavisinde kullanılan plastik bir kapaktır ve ara setini
kontaminasyondan korumak üzere povidon-iyot içerir.
4.3. Kontrendikasyonlar
İyoda karşı bilinen alerjik reaksiyon öyküsü varsa bu ürünü kullanmayınız. Daha fazla bilgi için doktorunuza başvurunuz.
Uyarılar
Aseptik teknik kullanınız. Sıvı yolunun herhangi bir kısmında kontaminasyon olması peritonit ile sonuçlanabilir.
Ambalajı daha önceden açılmış, hasar görmüş veya lekelenmişse ya da iç kısımda bulunan povidon-iyotlu sünger kuruysa kullanmayınız. Ürün kullanılmışsa atınız.
Oda sıcaklığında saklayınız. Aşırı ısıdan koruyunuz.
Bu ürün tek kullanımlıktır. Tek kullanımlık bir ürünün yeniden kullanılması veya yeniden işlemden geçirilmesi, kontaminasyona ve ürünün işlevinin veya yapısal bütünlüğünün zarar görmesine neden olabilir.
Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Kazara yutulması halinde, derhal doktorunuzadanışınız.
Küçük peritoneal diyalizat dolum hacmi olan hastalarda, özellikle bebek ve çocuklarda, tiroid fonksiyonunun izlenmesi tavsiye edilmektedir. İyot maruziyetini minimuma indirmek için, klinik olarak mümkün olduğunda, bir sonraki dolum döngüsünü başlatmadan önce periton boşluğundaki sıvıyı drenaj torbasına boşaltınız.
Diğer üreticilerden temin edilebilen pek çok diyaliz ürünü, Polifarma ekipmanı veya tek kullanımlık ürünleriyle birlikte kullanılmaktadır. Bu ürünlerdeki değişkenlik, toleranslar, mekanik kuvvet veya zaman zaman yapılabilecek değişiklikler Polifarma'nın kontrolü dışındadır. Bundan dolayı Polifarma, başka üreticilerin diyaliz ürünlerinin, kendi ürünleri ile kullanıldığında tatmin edici bir şekilde işleyeceğini garanti edemez.
Kullanım Talimatı
Dikkat: Aseptik teknik kullanınız.
Doktorunuz tarafından verilen talimatlara uyunuz. Bir yüz maskesi takınız. Ellerinizi dezenfektan özelliği olan sabun ile yıkayıp tamamen kurutunuz. Ellerinize antiseptik uygulayınız.
Yerel atık imha kılavuzları doğrultusunda atınız.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BALANCE | 8699684675202 | 429.25TL |
| BIOPERITONAL | 8699788673029 | |
| BIOPERITONEAL | 8699788676013 | |
| CAPD | 8699684671723 | 506.95TL |
| DIA. | 8699556675132 | |
| Diğer Eşdeğer İlaçlar |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Polifarma İlaç San.ve Tic. A.Ş.
| Geri Ödeme Kodu | A17471 |
| Satış Fiyatı | 665.77 TL [ 18 Oct 2024 ] |
| Önceki Satış Fiyatı | 665.77 TL [ 11 Oct 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699606886594 |
| Etkin Madde | Peritonal Diyaliz Solüsyonu |
| ATC Kodu | B05D |
| Birim Miktar | |
| Birim Cinsi | ML |
| Ambalaj Miktarı | 2500 |
| Kan ve Kan Yapıcı Organlar > Periton Diyalizi Solüsyonları |
| Yerli ve Beşeri bir ilaçdır. |