BREQUAL 50/500 mcg inhilasyon için toz içeren 60 kapsül Kısa Ürün Bilgisi
{ Flutikazon + Salmeterol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
BREQUAL 50 mcg / 500 mcg inhalasyon için toz içeren kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir inhalasyon kapsülü içinde:
Salmeterol ksinafoat* 72,50 mcg
Flutikazon propiyonat 500 mcg
*50 mcg Salmeterol' e eşdeğer
Yardımcı maddeler
Laktoz 11,95 mg (sığır sütünden elde edilir)
3. FARMASÖTİK FORMU
İnhalasyon için toz içeren kapsül
Şeffaf kapsül içinde beyaz ya da beyazımsı toz
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır.
4.2. Pozoloji ve uygulama şekli
BREQUAL sadece inhalasyon yolu ile uygulanır.
Hastalar, belirtileri olmasa dahi optimum fayda için BREQUAL' i düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır.
Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları BREQUAL dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir.
Alternatif olarak, uzun süre etkili betaagonist kullanması gereken hastalarda BREQUAL, reçete eden hekimin görüşüne göre hastalık kontrolünün sağlanmasında yeterli olacağı düşünülüyorsa günde bir kez olacak şekilde de titre edilebilir. Hastada gece görülen semptom öyküsü varsa ve günde bir kez dozlam uygulanıyorsa doz geceleri verilmeli; hastada genellikle gündüz görülen semptom öyküsü varsa doz sabahları verilmelidir.
Astım
Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde 2 kez uygulanan BREQUAL ile belirtilerin kontrolü sağlandığında, etkili en düşük doz açısından,
günde 1 kez uygulanan BREQUAL de değerlendirmeye dahil edilebilir.
Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren BREQUAL verilmelidir.
Eğer hasta yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilemiyorsa tedavinin terapötik olarak eşdeğer kortikosteroid dozunda BREQUAL ile değiştirilmesi astım kontrolünde düzelme sağlayabilir. Astımı yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilebilen hastalarda tedavinin BREQUAL ile değiştirilmesi astım kontrolünü sürdürürken kortikosteroid dozunun azaltılmasını sağlayabilir. Daha ayrıntılı bilgi için lütfen Farmakodinamik özellikler bölümüne bakınız.
Tavsiye Edilen Dozlar:
Yetişkinler, 12 yaş ve üzeri adolesanlar:
Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat)
veya
günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat)
veya
günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 500 mikrogram flutikazon propiyonat).
Hızlı şekilde kontrol edilmesi gereken, orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına ve orta ila şiddetli havayolu sınırlamasına göre tanımlanır) kısa süreli BREQUAL uygulaması başlangıç tedavisi olarak kabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde iki kez iki inhalasyon olarak 50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonattır. Astım kontrolü sağlandığında, tedavi tekrar gözden geçirilmeli ve hastaların, tek başına inhale kortikosteroid alacak şekilde dozun azaltılması düşünülmelidir. Tedavide doz azaltılırken hastaların düzenli olarak takip edilmesi önemlidir.
Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarak inhale kortikosteroidler hastaların büyük çoğunluğunda birinci basamak tedavi olmaya devam etmektedir. BREQUAL'in hafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. BREQUAL 50 mikrogram /100 mikrogram dozları, şiddetli astımı olan çocuklarda ve erişkinlerde kullanıma uygun değildir; şiddetli astım hastalarında herhangi bir sabit kombinasyonun kullanılmasından önce uygun inhale kortikosteroid dozunun gösterilmesi önemlidir.
Kronik Obstrüktif Akciğer Hastalığı (KOAH)
Yetişkin hastalar için tavsiye edilen doz günde 2 kez 1 inhalasyon 50/250 mikrogram - 50/500 mikrogram salmeterol/flutikazon propiyonattır.
Uygulama şekli:
BREQUAL sadece inhalasyon yoluyla kullanılır.
Hastalara inhalerlerini doğru şekilde kullanmaları için bilgi verilmelidir. İnhalasyon sırasında, hastanın tercihen ayakta veya dik oturur konumda olması gerekir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda BREQUAL kullanımına ilişkin bilgi yoktur.
Pediyatrik popülasyon:
4 -12 yaş arası çocuklarda:
Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat).
yaşından küçük çocuklarda BREQUAL kullanımı ile ilgili bilgi yoktur.
Geriyatrik popülasyon:
Yaşlı hastalarda doz ayarlanmasına gerek yoktur.
4.3. Kontrendikasyonlar
BREQUAL, etkin madde veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir (bkz. bölüm 6.1).
4.4. Özel kullanım uyarıları ve önlemleri
Hastalığın kötüleşmesi
BREQUAL'in içeriğinde bulunan salmeterol gibi uzun etkili βagonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay
hastalar yakından takip edilmelidir.
BREQUAL hızlı ve kısa etkili bronkodilatör (örneğin salbutamol) kullanımı gerektiren akut belirtileri rahatlatmak için kullanılmamalıdır. Hastalara akut astım ataklarında rahatlamak için kullanmaları gereken ilaçları her zaman yanlarında bulundurmaları tavsiye edilmelidir.
Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır.
BREQUAL ile tedavi sırasında astımla ilişki ciddi adves etkiler veya alevlenmeler gerçekleşebilir. Hastalara, BREQUAL tedavisine başladıktan sonra astım semptomları kontrol altına alınamaz veya kötüleşirse tedaviye devam etmeleri, ancak yine de hekimlerine danışmaları gerektiği anlatılmalıdır.
Rahatlatıcı ilaç (kısa etkili bronkodilatörler) kullanımı gereksinimlerinde artış veya rahatlatıcı ilaçlara yanıtta azalma astım kontrolünde bozulmaya işaret eder ve hastalar bir hekim tarafından değerlendirilmelidir.
Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve hastanın bir hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozunun artırılması düşünülmelidir.
Astım semptomları kontrol altına alındığında, BREQUAL dozunun kademeli olarak
azaltılması değerlendirilebilir. Tedavi kademeli olarak azaltılırken hastaların düzenli olarak
kontrol edilmesi önemlidir. BREQUAL'in etkili en düşük dozu kullanılmalıdır (bkz. Bölüm 4.2).
Alevlenme yaşayan KOAH hastalarında genellikle sistemik kortikosteroid kullanımı endikedir, bu nedenle BREQUAL ile semptomlar kötüleşirse hastaların hekimlerine danışmaları gerektiği anlatılmalıdır.
Astımlı hastalarda alevlenme riski nedeniyle BREQUAL tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lı hastalarda tedavinin kesilmesine semptomatik dekompanzasyon eşlik edebilir ve tedavinin kesilmesi bir hekim gözetiminde yapılmalıdır.
Kortikosteroid içeren tüm inhale ilaçlarla olduğu gibi, aktif veya sessiz akciğer tüberkülozu olan hastalarda ve mantar, virüs ya da diğer solunum yolu enfeksiyonları olan hastalarda BREQUAL dikkatli kullanılmalıdır. Gerekli olduğu takdirde uygun tedavi derhal başlatılmalıdır.
Kardiyovasküler etkiler
Yüksek terapötik dozlarda BREQUAL, seyrek olarak kardiyak aritmilere (örn. supraventriküler taşikardi, esktrasistoli ve atriyal fibrilasyon) ve serum potasyum seviyesinde geçici hafif azalmalara neden olabilir. Ciddi kardiyovasküler bozuklukları veya kalp ritm ritim bozuklukları olan hastalarda ve diabetes mellitus, tirotoksikozis, tedavi edilmemiş hipokalemi veya düşük serum potasyum seviyesine predispoze hastalarda BREQUAL dikkatli kullanılmalıdır.
Hiperglisemi
Çok seyrek olarak kan glukoz düzeylerinde artış rapor edilmiştir (bkz. Bölüm 4.8) ve diabetes mellitus öyküsü olan hastalara reçete edilirken bu husus göz önünde bulundurulmalıdır.
Paradoksal bronkospazm
Diğer inhalasyon tedavilerinde olduğu gibi, doz uygulamasından hemen sonra başlayan hırıltı artışı ve nefes darlığı ile birlikte paradoksal bronkospazm ortaya çıkabilir. Paradoksal bronkospazm, hızlı etkili bronkodilatöre yanıt verir ve hemen tedavi edilmelidir. BREQUAL derhal kesilmeli, hasta değerlendirilmeli ve gerekli ise alternatif tedaviye başlanmalıdır.
ï¢agonist tedavisinin tremor, çarpıntılar ve baş ağrısı gibi farmakolojik yan etkileri
bildirilmiştir fakat bunlar geçici olma ve düzenli tedaviyle birlikte azalma eğilimindedir.
Sistemik kortikosteroid etkiler
Herhangi bir inhale kortikosteroid özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığı çok daha azdır (bkz. Bölüm 4.9). Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon, çocukların ve adolesanların büyümesinde gecikme, kemik mineral dansitesinde azalma, katarakt ve glokom ile daha seyrek olarak psikomotor hiperaktivite, uyku bozukluğu, anksiyete, depresyon ve agresyon (özellikle çocuklarda) gibi psikolojik ve davranışsal etkileri içerir. Bu nedenle, astımı olanlarda tedavinin düzenli olarak değerlendirilmesi ve inhale kortikosteroid dozunun, etkili kontrolü sağlayan en düşük doza ayarlanması önemlidir.
Hastaların yüksek dozlarda inhale kortikosteroidlerle uzun süreli tedavisi adrenal supresyon ve akut adrenal krize neden olabilir. 500 ila 1000 mikrogram flutikazon propiyonat dozlarında çok seyrek olarak adrenal supresyon ve akut adrenal krizler ile ilgili bildirimler bulunmaktadır. Potansiyel olarak akut adrenal krizi tetikleyebilecek durumlar travma, cerrahi girişim, enfeksiyon veya dozda ani azalmalardır. Gözlenen semptomlar genellikle belirsiz olmakla birlikte anoreksi, karın ağrısı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, bilinç seviyesinde azalma, hipoglisemi ve nöbettir. Stres veya elektif cerrahi girişim sırasında ilave sistemik kortikosteroid tedavisi düşünülmelidir.
İnhale flutikazon propiyonat tedavisinin oral steroid ihtiyacını minimize etmesi beklenir, ancak oral steroidlerden transfer edilen hastalarda önemli bir süre adrenal yetmezlik riski olabilir. Bu nedenle bu tip hastaların yakından takip edilmesi ve adrenokortikol fonksiyonun izlenmesi gereklidir. Geçmişinde acil durum yüksek doz kortikosteroid tedavisi gereken hastalarda da bu risk mevcut olabilir. Stres yaratması muhtemel acil ve elektif durumlarda adrenal yanıt bozukluğu olasılığı daima akılda tutulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir. Adrenal yetmezliğin derecesi elektif girişimlerden önce uzman değerlendirmesi gerektirebilir.
Ritonavir, plazmadaki flutikazon propiyonat konsantrasyonunu büyük ölçüde artırabilir. Bu nedenle hastaya potansiyel yararı sistemik kortikosteroid yan etkilerinden fazla olmadığı sürece birlikte kullanımdan kaçınılmalıdır. Flutikazon propiyonat'ın diğer güçlü CYP3A inhibitörleriyle birlikte kullanımında da sistemik yan etki riski artar.
KOAH hastalarında pnömoni
Kortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir.
Kortikosteroid içeren inhaler ilaçların pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır.
Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatli olmalıdırlar.
KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara kullanımı, ileri yaş, düşük
vücut kitle indeksi ve şiddetli KOAH bulunmaktadır.
CYP3A4 inhibitörleriyle etkileşim
Sistemik ketokonazol ile birlikte kullanımı salmetorol'ün sistemik maruziyetini ciddi ölçüde artırmaktadır. Bu durum sistemik etkilerin (örn. QTc aralığının uzaması ve palpitasyonlar) insidansında artışa neden olabilir. Bu nedenle hastaya olan potansiyel yararı sistemik salmeterol yan etkileri riskinden fazla olmadıkça CYP3A4 inhibitörleriyle birlikte kullanımından kaçınılmalıdır.
Görme bozuklukları
Sistemik ve topikal kortikosteroid kullanımında görme bozuklukları rapor edilebilir. Bir
hastada bulanık görüş veya diğer görme bozukluğu şikayetleri varsa hasta, sistemik ve topikal
kortikosteroid kullanımı sonrası bildirilen katarakt, glokom veya santral seröz korioretinopati (CSCR) gibi olası nedenlerin değerlendirilmesi için oftalmoloji uzmanına yönlendirilmelidir.
Pediyatrik popülasyon
Yüksek doz flutikazon propiyonat (genellikle 1000mikrogram/gün veya daha fazla) alan 16 yaşın altındaki çocuklar ve ergenler risk altında olabilir. Özellikle yüksek dozlarda uzun süreli tedavide sistemik etkiler gerçekleşebilir. Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon, akut adrenal kriz, çocukların ve adolesanların büyümesinde gecikme ile daha seyrek olarak psikomotor hiperaktivite, uyku bozukluğu, anksiyete, depresyon ve agresyondur. Çocuk veya ergen hastanın pediyatrik solunum uzmanına sevk edilmesi düşünülmelidir.
Uzun süre inhale kortikosteroid tedavisi alan çocukların boyunun düzenli olarak izlenmesi tavsiye edilmektedir. İnhale kortikosteroid astım kontrolünü sağlayan en düşük dozda kullanılmalıdır.
Yardımcı maddeler
BREQUAL'in her bir dozu 12,35 miligrama kadar laktoz içerir. Bu miktar, laktoz intoleransı olan kişilerde normalde bir probleme neden olmamaktadır. Laktoz yardımcı maddesi küçük miktarlarda süt proteini içerir ve bu alerjik reaksiyonlara neden olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
β adrenerjik blokörler salmeterolün etkisini zayıflatabilir veya antagonize edebilir. Astımlı hastalarda kullanımları için gerekli nedenler olmadığı sürece hem selektif olmayan hem de selektif β blokörlerin kullanımından kaçınılmalıdır. β2 agonist tedavisiyle potansiyel olarak ciddi hipokalemi gerçekleşebilir. Akut şiddetli astımda, bu etki ksantin türevleri, steroidler ve diüretikler ile eş zamanlı tedavi ile artabileceğinden özel dikkat tavsiye edilir.
Diğer beta adrenerjik içeren ilaçların eş zamanlı kullanımı potansiyel olarak aditif bir etkiye sahip olabilir.
Flutikazon Propiyonat
Normal şartlar altında, inhalasyon yolu ile uygulanmasından sonra, geniş ilk geçiş metabolizması ve karaciğer ve bağırsakta sitokrom CYP3A4'ün aracılık ettiği yüksek sistemik klerens sonucu, flutikazon propiyonatın plazma konsantrasyonu düşüktür. Bu nedenle, flutikazon propiyonatın aracılık ettiği klinik olarak anlamlı ilaç etkileşimi olası değildir.
Sağlıklı gönüllüler üzerinde yapılan bir ilaç etkileşim çalışması, günde 2 defa 100 mg ritonavirin (oldukça güçlü sitokrom CYP3A4 inhibitörü), flutikazon propiyonatın plazma konsantrasyonlarını birkaç yüz kat artırabildiğini ve serum kortizol konsantrasyonlarında anlamlı azalmaya yol açtığını göstermiştir. İnhale flutikazon propiyonat için bu etkileşime dair bilgi bulunmamaktadır, ancak flutikazon propiyonat plazma seviyelerinde anlamlı artış beklenmektedir. Cushing sendromu ve adrenal supresyon vakaları bildirilmiştir. Bu nedenle, hastaya olan potansiyel yararı sistemik kortikosteroid yan etkileri riskinden fazla olmadıkça, ritonavir ve flutikazon propiyonatın birlikte kullanımından kaçınılmalıdır.
Sağlıklı gönüllülerde yapılan küçük ölçekli bir çalışmada daha düşük potense sahip bir CYP3A inhibitörü olan ketokonazol tek inhalasyondan sonra flutikazon propiyonat maruziyetini %150 artırmıştır. Bu etki tek başına flutikazon propiyonata kıyasla plazma
kortizol düzeyinde daha fazla düşüşe neden olmuştur. İtrakonazol ve kobisistat içeren ilaçlar gibi diğer potent CYP3A inhibitörleri ve eritromisin gibi orta kuvvetli CYP3A inhibitörleri ile birlikte tedavinin de sistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini artırması beklenmektedir. Hastaya olan potansiyel yararı sistemik kortikosteroid yan etkileri riskinden fazla olmadıkça, birlikte kullanımdan kaçınılmalıdır. Birlikte kullanımda hastalar sistemik kortikosteroid yan etkileri açısından takip edilmelidir.
Salmeterol
Kuvvetli CYP3A4 inhibitörleri
15 sağlıklı gönüllüde 7 gün süreyle yürütülen bir ilaç etkileşim çalışmasında eş zamanlı sistemik ketokonazol (günde bir kez 400 mg) ve salmeterol (günde iki kez inhale 50 mikrogram) kullanımının plazma salmeterol maruziyetini anlamlı derecede artırdığı gözlenmiştir (C1,4 kat ve EAA 15 kat). Bu durum, salmeterol tedavisinin diğer sistemik etkilerinin (örn. QTc aralığının uzama ve palpitasyonlar) insidansının tek başına salmeterol veya ketokonazole tedavisi ile karşılaştırıldığında artmasına neden olabilir.
Kan basıncı, kalp hızı, kan glukoz ve kan potasyum düzeylerinde klinik açıdan anlamlı etkiler görülmemiştir. Ketokonazol ile birlikte uygulanımı salmeterol eliminasyon yarı ömrünü veya tekrarlı dozlamla salmeterol birikimini artırmamıştır.
Tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden yüksek olmadığı sürece ketokonazol ile eş zamanlı kullanımından kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleri ile benzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol, telitromisin, ritonavir).
Orta düzeyde CYP 3A4 inhibitörleri
15 sağlıklı gönüllüde 6 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mikrogram) ve eritromisin (oral yolla günde bir kez 500 mg) uygulanımı salmeterol maruziyetinde küçük ancak istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur (C1,4 kat ve EAA 1,2 kat). Eritromisinin birlikte uygulanımı herhangi bir ciddi yan etki ile ilişkilendirilmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Yaşlı hastalarda veya böbrek veya karaciğer yetmezliği olan hastalarda etkileşim çalışmaları yapılmamıştır (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
Pediyatrik hastalarda etkileşim çalışmaları yapılmamıştır (bkz. Bölüm 5.2).
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) BREQUAL' in doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır.
Gebelik dönemi
BREQUAL' in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebe kadınlardan elde edilen veriler (1000'den fazla gebe vakası) salmeterol ve flutikazon propiyonat malformasyon veya feto/neonatal toksisitesi göstermemektedir. Hayvan çalışmaları β2 adrenoreseptör agonistleri ve glukokortikosteroidlerin uygulamasından sonra üreme toksisitesi göstermiştir (bkz. Bölüm 5.3).
İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir.
Gebe kadınlarda flutikazon propiyonatın astım kontrolünü sağlayan etkili en düşük dozu
kullanılmalıdır.
Laktasyon dönemi
Salmeterol ve flutikazon propiyonat/metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir.
Çalışmalar salmeterol ve flutikazon propiyonat ve metabolitlerinin emziren sıçanların sütüne
geçtiğini göstermiştir.
Emzirilen yenidoğanlarda/bebeklerde risk göz ardı edilemez. Çocuk için emzirmenin faydası ve anne için tedavinin faydası göz önünde bulundurularak BREQUAL tedavisinin emzirmenin veya tedavinin bırakılmasına karar verilmelidir.
Üreme yeteneği/Fertilite
İnsanlarda kullanımına dair veri bulunmamaktadır. Ancak, hayvan çalışmaları salmeterol veya flutikazon tedavisinin fertilite üzerinde etkisi olmadığını göstermiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
BREQUAL' in araç ve makine kullanımı üzerinde etkisi yoktur veya göz ardı edilebilir düzeydedir.
4.8. İstenmeyen etkiler
BREQUAL, salmeterol ve flutikazon propiyonat içerdiğinden her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşiğin birlikte verilmesiyle ilave advers etki bildirilmemiştir.
Salmeterol/flutikazon propiyonat ile ilgili advers olaylar sistem organ sınıfına göre aşağıdaki sıklıklarda verilmiştir:
Çok yaygın (≥1/10); yaygın (â¥1/100 ila <1/10); yaygın olmayan (â¥1/1.000 ila <1/100); seyrek (â¥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Sıklıklar klinik çalışma verilerinden elde edilmiştir. Plasebodaki insidans göz önünde bulundurulmamıştır.
Enfeksiyonlar ve enfestasyonlar
Yaygın: Ağız ve boğazda kandidiyaz, pnömoni (KOAH hastalarında), bronşit
Seyrek: Özofajiyal kandidiyaz
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Kütanöz duyarlılık reaksiyonları, solunum semptomları (dispne)
Seyrek: Anjiyoödem (temelde yüzde ve orofarinksde ödem), solunum semptomları (bronkospazm), anafilaktik şok dahil, anafilaktik reaksiyonlar
Endokrin hastalıkları
Seyrek: Cushing sendromu, Cushing benzeri özellikler, adrenal supresyon, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu
Metabolizma ve beslenme hastalıkları
Yaygın: Hipokalemi
Yaygın olmayan: Hiperglisemi
Psikiyatrik hastalıklar
Yaygın olmayan: Anksiyete, uyku bozuklukları
Seyrek: Psikomotor hiperaktivite ve iritabilite dahil davranış değişiklikleri (çoğunlukla
çocuklarda)
Bilinmiyor: Depresyon, huzursuzluk (çoğunlukla çocuklarda)
Sinir sistemi hastalıkları Çok yaygın: Baş ağrısı Yaygın olmayan: Tremor
Göz hastalıkları
Yaygın olmayan: Katarakt Seyrek: Glokom Bilinmiyor: Bulanık görme
Kardiyak hastalıklar
Yaygın olmayan: Palpitasyon, taşikardi, atriyal fibrilasyon, angina pektoris Seyrek: Kardiyak aritmi (supraventriküler taşikardi ve ekstrasistol dahil)
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın : Nazofarenjit
Yaygın : Boğaz iritasyonu, ses kısıklığı/disfoni, sinüzit
Seyrek : Paradoksikal bronkospazm
Deri ve deri altı doku hastalıkları
Yaygın : Kontüzyonlar
Kas-iskelet bozuklukları, bağdoku ve kemik hastalıkları
Yaygın : Kas krampları, travmatik kırıklar, artralji, miyalji
Seçili advers olayların tanımı
ï¢agonist tedavisinin tremor, çarpıntılar ve baş ağrısı gibi farmakolojik yan etkileri
bildirilmiştir fakat bunlar geçici olma ve düzenli tedaviyle birlikte azalma eğilimindedir.
Diğer inhalasyon tedavilerinde olduğu gibi, doz uygulamasından hemen sonra başlayan hırıltı artışı ve nefes darlığı ile birlikte paradoksal bronkospazm ortaya çıkabilir. Paradoksal bronkospazm, hızlı etkili bronkodilatöre yanıt verir ve hemen tedavi edilmelidir. BREQUAL derhal kesilmeli, hasta değerlendirilmeli ve gerekli ise alternatif tedaviye başlanmalıdır.
Flutikazon propiyonat içeriği nedeniyle bazı hastalarda ses kısıklığı ağız ve boğaz kandidiyazı (pamukçuk) ve seyrek vakalarda özofagus kandidiyazı (pamukçuk) görülebilir. Gerek ses kısıklığı gerekse ağız ve boğaz kandidiyazı insidansı, ürün kullanıldıktan sonra ağız yıkanarak ve/veya dişler fırçalanarak giderilebilir. Semptomatik ağız ve boğaz kandidiyazı, BREQUAL tedavisi devam ederken topikal anti-fungal terapi ile tedavi edilebilir.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon
Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon, çocukların ve adolesanların büyümesinde gecikmedir (bkz. Bölüm 4.4). Çocuklarda ayrıca anksiyete, uyku bozukluğu ve hiperaktiviteyle iritabilite gibi davranışsal değişiklikler görülebilir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; eposta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
ve - 2.1 arasında; p < 0,001), salmeterole kıyasla - 2.2 birim (p < 0,001) ve FP'ye kıyasla -
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Kortikosteroidler ve Diğer İlaçlar ile Kombine Adrenerjikler (Antikolinerjik Kombinasyonları Hariç)
ATC Kodu: R03AK06
Etki mekanizması
BREQUAL farklı etki şekline sahip salmeterol ve flutikazon propiyonat içermektedir. İki etkin maddenin ilgili etki mekanizmaları aşağıda tartışılmaktadır.
Salmeterol
Salmeterol, reseptörün sekonder bağlanma bölgesine bağlanan uzun bir yan zincire sahip selektif uzun etkili (12 saat) bir beta-adrenoseptör agonisttir. Salmeterol klasik kısa etkili beta2-agonistlerin önerilen dozlarına kıyasla en az 12 saat süren daha uzun süreli bronkodilatasyon sağlamaktadır.
Flutikazon propiyonat
Önerilen dozlarda inhalasyon yoluyla verilen flutikazon propiyonat akciğerlerde bir glukokortikoid antienflamatuvar etkiye sahiptir ve bu etki kortikosteroidler sistemik yolla uygulandığında görülenden daha az yan etkiyle semptomlarda ve astım alevlenmelerinde azalma sağlamaktadır.
Klinik etkililik ve güvenlilik
Salmeterol/Flutikazon İnhalasyon İçin Toz ile yapılan astım klinik çalışmaları
İnatçı astımı olan 3416 erişkin ve adolesanda yapılan 12 aylık bir çalışmada (Optimal Astım Kontrolünü Sağlanması, GOAL) astım tedavisi hedeflerinin erişilebilir olup olmadığının belirlenmesi için tek başına inhale kortikosteroidler (Flutikazon Propiyonat) ile Salmeterol/Flutikazon 100 mikrogram İnhalasyon İçin Toz' un etkililik ve güvenliliği karşılatırılmıştır. Tedavi dozu **Toplam kontrol sağlanana veya çalışma ilacının en yüksek dozuna erişilene kadar 12 haftada bir artırılmıştır. GOAL, Salmeterol/Flutikazon İnhalasyon İçin Toz verilen hastadan tek başına inhale kortikosteroid (IKS) verilen hastalara kıyasla daha fazla hastada astım kontrolü sağlandığı ve bu kontrolün daha düşük kortikosteroid dozunda elde edildiğini göstermiştir.
*İyi kontrol altına alınmış astım, tek başına IKS'ye kıyasla Salmeterol/Flutikazon İnhalasyon İçin Toz ile daha hızlı şekilde elde edilmiştir. Bireysel olarak iyi kontrolün sağlandığı haftanın elde edilmesi için hastaların %50'sindeki tedavi süresi Salmeterol/Flutikazon İnhalasyon İçin Toz için 16 gün ve IKS grubunda 37 gündü. Daha önce steroid tedavisi alamayan bir hasta alt grubunda bireysel iyi kontrol altına alınmış haftaya kadar geçen süre Salmeterol/Flutikazon İnhalasyon İçin Toz ile 16 gün olurken IKS ile 23 gün olmuştur.
Genel çalışma bulguları aşağıdakileri göstermiştir:
12 Ayda *İyi Kontrol Altına Alınmış (WC) ve **Tam Olarak Kontrol Altına Alınmamış (TC) Astımlı Hastaların Oranı | ||||
Çalışma Öncesi Tedavi | Salmeterol/FP | FP | ||
WC | TC | WC | TC | |
IKS yok (tek başına kısa etki süreli beta agonisti SABA) | %78 | % 50 | % 70 | % 40 |
Düşük doz IKS (≤500mcg beklometazon dipropiyonat (BDP) veya eşdeğer/gün) | %75 | %44 | %60 | %28 |
Orta doz IKS (>500-1000mcg dipropiyanat BDP veya eşdeğer/gün) | %62 | %29 | %47 | %16 |
3 tedavi düzeyinde birleştirilmiş bulgular | %71 | %41 | %59 | %28 |
*Yeterli düzeyde kontrol altına alınan astım; >1 semptom skoru ile ⤠2 gün (semptom skoru 1, âgün içinde bir kısa süreli semptom' şeklinde tanımlanır), â¤2 gün ve haftada â¤4 SABA kullanımı, ≥ %80 öngörülen sabah pik ekspiratuar akımı, gece uyanmalarının olmaması, alevlenmelerin olmaması ve tedavi değişikliği gerektiren yan etkilerin olmaması
**Tam kontrol altına alınan astım; semptomların olmaması, SABA kullanımının olmaması, â¥
%80 öngörülen sabah pik ekspiratuar akışı, gece uyanmalarının olmaması, alevlenmelerin olmaması ve tedavi değişikliği gerektiren yan etkilerin olmaması
Bu çalışmadaki bulgular günde iki kez Salmeterol/Flutikazon 50/100 mikrogram dozunun, hızlı astım kontrolünün gerekli olduğu düşünülen orta şiddette dirençli astım hastalarında ilk idame tedavisi olarak değerlendirilebileceğini düşündürmektedir.
â¥18 yaşındaki dirençli astım hastası 318 kişide yapılan bir çift kör, randomize, paralel gruplu çalışmada iki haftalık sürede günde iki kez iki inhalasyonla (çift doz) Salmeterol/Flutikazon İnhalasyon İçin Toz kullanımının güvenlilik ve tolerabilitesi değerlendirilmiştir. Bu çalışma 14 güne kadar her Salmeterol/Flutikazon İnhalasyon İçin Toz dozu inhalasyonunun iki katına çıkarılmasının günde iki kez tek inhalasyona kıyasla beta agonist ile ilişkili yan etkilerde küçük bir artışa (tremor; 0'a karşı 1 hasta [%1], palpitasyon; 1 hastaya [<%1] karşı 6 [%3], kas krampları; 1 [<%1] hastaya karşı 6 [%3] ) ve inhale kortikosteroid ile ilişkili yan etkilerde benzer bir insidansa neden olduğunu göstermiştir (örn, oral kandidiyazis; 16 hastaya [%8] karşı 6 [%6], ses kısıklığı; 4 hastaya [%2] karşı 2 [%2]). Salmeterol/Flutikazon İnhalasyon İçin Toz dozunun ek kısa süreli (14 güne kadar) inhale kortikosteroid tedavisine ihtiyaç duyulan erişkin hastalarda iki katına çıkarılması düşünülürse beta agonist ile ilişkili yan etkilerdeki küçük artış dikkate alınmalıdır.
Astım
Çok Merkezli Salmeterol Astım Araştırma Çalışması
Çok Merkezli Salmeterol Astım Araştırma Çalışması, yetişkin ve ergen gönüllülerde olağan tedaviye salmeterol veya plasebo eklenmesinin güvenliliğini karşılaştıran 28 haftalık bir ABD çalışmasıydı. Solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olayların kombine sayısı olan primer sonlanım noktası açısından anlamlı farklılık olmasa da, çalışma salmeterol alan hastalarda astımla ilişkili ölüm sayısında anlamlı artış göstermiştir (salmeterol ile tedavi edilen 13.176 hastada 13 ölüme kıyasla plasebo alan 13.179 hastada 3 ölüm).
Çalışma eş zamanlı inhale kortikosteroid kullanımının etkisini değerlendirmek için
tasarlanmamıştır ve gönüllülerin yalnızca %47'si başlangıçta İKS kullanımını bildirmiştir.
Astımda salmeterol+flutikazon propiyonat ile tek başına flutikazon propiyonatın güvenliliği ve etkililiği Salmeterol+flutikazon propiyonat ile tek başına flutikazon propiyonat'ın güvenliliği ve etkililiğini karşılaştırmak için biri yetişkin ve ergen gönüllülerde (AUSTRI çalışması), diğeri 4-11 yaşlarında pediyatrik gönüllülerde (VESTRI çalışması) olmak üzere iki tane çok merkezli 26 haftalık çalışma yürütülmüştür. Her iki çalışmaya dahil edilen gönüllülerin bir önceki yılda astımla ilişkili hastaneye yatış veya astım alevlenmesi ile birlikte orta ile şiddetli inatçı astımı vardı. İki çalışmanın da primer hedefi tek başına İKS'ye (flutikazon propiyonat) kıyasla İKS tedavisine LABA eklenmesinin (salmeterol+flutikazon propiyonat) astımla ilişkili olaylar (astımla ilişkili hastaneye yatış, endotrakeyal entübasyon ve ölüm) açısından noninferioriteyi değerlendirmekti. Çalışmanın ikincil hedefi ciddi astım alevlenmesi (astımın kötüye gitmesi nedeniyle en az 3 gün sistemik kortikosteroid kullanımına gerek olması veya sistemik kortikosteroid kullanımı gerektiren astım nedenli hastaneye veya acile yatış olarak tanımlanmıştır) açısından İKS+LABA'nın (salmeterol+flutikazon propiyonat) tek başına İKS tedavisine (flutikazon propiyonat) üstünlüğünü değerlendirmekti.
AUSTRI ve VESTRI çalışmalarına sırasıyla 11.679 ve 6.208 hasta randomize edilmiş ve tedavi görmüştür. Primer sonlanma noktası güvenlilik için, her iki çalışmada da noninferiorite gösterilmiştir (bkz. aşağıda tablo)
26 haftalık AUSTRI ve VESTRI çalışmalarında astımla ilişkili ciddi olaylar
| AUSTRI | VESTRI | ||
| Salmeterol+ Flutikazon propiyonat (n=5.834) | Tek başına flutikazon propiyonat (n=5.845) | Salmeterol+ Flutikazon propiyonat (n=3.107) | Tek başına flutikazon propiyonat (n=3.101) |
Birleşik sonlanma noktası (astımla ilişkili hastaneye yatış, endotrakeyal entübasyon ve ölüm) | 34 (%0,6) | 33 (%0,6) | 27 (%0,9) | 21 (%0,7) |
Salmeterol+flutikazon propiyonat/flutikazon propiyonat risk oranı (GA: %95) | 1,029 (0,638-1,622) |
| 1,285 (0,726-2,272) |
|
Ölüm | 0 | 0 | 0 | 0 |
Astımla ilişkili hastaneye yatış | 34 | 33 | 27 | 21 |
Endotrakeyal entübasyon | 0 | 2 | 0 | 0 |
verilmiştir
verilmiştir
İkincil etkililik sonlanma noktası için, flutikazon propiyonat ile karşılaştırıldığında salmeterol+flutikazon propiyonatta ilk astım alevlenmesine kadar geçen sürede azalma her iki
çalışmada da görülmüştür, ancak yalnızca AUSTRI'de istatistiksel olarak anlamlı fark
sağlanmıştır:
| AUSTRI | VESTRI | ||
| Salmeterol+ Flutikazon propiyonat (n=5.834) | Tek başına flutikazon propiyonat (n=5.845) | Salmeterol+ Flutikazon propiyonat (n=3.107) | Tek başına flutikazon propiyonat (n=3.101) |
Astım alevlenmesi olan gönüllülerin sayısı | 480 (%8) | 597 (%10) | 265 (%9) | 309 (%10) |
Salmeterol+flutikazon propiyonat/flutikazon propiyonat risk oranı (GA: %95) | 0,787 (0,698 , 0,888) | 0,859 (0,729 , 1,012) | ||
KOAH
Kısa etkili beta-agonistlerine % 10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları:
6 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500 mikrogramlık Salmeterol/Flutikazon İnhalasyon İçin Toz'u düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlı derecede azalttığını göstermiştir. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur.
Kısa etkili beta-agonistlerine % 10'dan daha az reversibilite gösteren semptomatik KOAH hastaları:
6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram Salmeterol/Flutikazon İnhalasyon İçin Toz'un düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlı derecede azalttığını göstermiştir. 12 aylık periyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroid ihtiyacı anlamlı derecede azalmıştır. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur.
Salmeterol/Flutikazon İnhalasyon İçin Toz 50/500 mikrogram hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalarda akciğer fonksiyonunu ve sağlık durumunu düzeltmede ve KOAH alevlenme riskini azaltmada etkili bulunmuştur.
TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru): TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram Salmeterol/Flutikazon İnhalasyon İçin Toz, günde 2 kez 50 mikrogram salmeterol, günde 2 kez 500 mikrogram FP (flutikazon propiyonat) veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümler üzerindeki etkisini değerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç (bronkodilatatörden önce) FEV'i beklenen normal değerin % 60'ından az olan orta-şiddetli ve şiddetli KOAH hastaları çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süre sistemik kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık sağkalım durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Primer sonlanma noktası, plaseboya kıyasla Salmeterol/Flutikazon İnhalasyon İçin Toz, için 3 yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır. (Tablo 1)
Tablo 1
| Plasebo N = 1524 | Salmeterol 50 N = 1521 | FP 500 N = 1534 | Salmeterol/Flutikazon 50/500 N = 1533 |
3 yılda tüm nedenlere bağlı ölüm | ||||
Ölüm sayısı | 231 | 205 | 246 | 193 |
(%) | (% 15,2) | (% 13,5) | (% 16) | (% 12,6) |
Plaseboya karşı risk oranı | Geçerli | 0,879 | 1,060 | 0,825 |
(GA) p değeri | değil | (0,73 , 1,06) | (0,89 , 1,27) | (0,68 , 1,00) |
|
| 0,180 | 0,525 | 0,052 |
Risk oranı, | Geçerli | 0,932 | 0,774 | Geçerli değil |
komponentlerine karşı | değil |
|
|
|
Salmeterol/Flutikazon |
| (0,77 , 1,13) | (0,64 , 0,93) |
|
50/500 (GA) p değeri |
| 0,481 | 0,007 |
|
1. birincil etkinlik karşılaştırılması üzerinde yapılmış 2 ara analizin sigara içme durumu
açısından gruplandırılmış bir log-rank analizi için ayarlanmış P değeri.
Salmeterol/Flutikazon, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini % 17,5 oranında azalttığı görülmüştür. (Risk Oranı 0,825 (% 95 GA 0,68 , 1,00 , p = 0,052; tümü ara analizler için ayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamanda herhangi bir nedenden dolayı gerçekleşen ölümlerde, salmeterol ile % 12 azalma (p = 0,180) ve FP ile % 6 artış (p = 0,525) olmuştur. (Tablo 1)
Cox'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren Salmeterol/Flutikazon İnhalasyon İçin Toz için 0,811'lik (% 95 GA 0,670 , 0,982 , p = 0,031) bir risk oranı olduğunu göstermiştir. Model önemli faktörler (sigara içme durumu, yaş, cinsiyet, bölge, başlangıç FEVve Vücut Kitle İndeksi) için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur. (Tablo 1)
Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için %6,
salmeterol için % 6,1 , FP için % 6,9 ve Salmeterol/Flutikazon İnhalasyon İçin Toz için
%4,7'dir. (Tablo 1)
Plaseboya kıyasla Salmeterol/Flutikazon İnhalasyon İçin Toz, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p < 0,001) oranında azaltmıştır. Salmeterol/Flutikazon İnhalasyon İçin Toz alevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19 arasında; p = 0,002), FP ile karşılaştırıldığında da % 9 (% 95 GA: % 1 ve % 16 arasında; p = 0,024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15 (% 95 GA: % 7 ve % 22 arasında; p < 0,001) ve % 18 (% 95 GA: % 11 ve % 24 arasında; p < 0,001) oranında azaltmıştır.
St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca Salmeterol/Flutikazon İnhalasyon İçin Toz ile sağlanan ortalama düzelme plaseboya kıyasla - 3.1 birim (% 95 GA: -
ve - 2.1 arasında; p < 0,001), salmeterole kıyasla - 2.2 birim (p < 0,001) ve FP'ye kıyasla -
5.2. Farmakokinetik özellikler
Genel özelliklerHayvanlarda veya insanlarda inhalasyon yoluyla birlikte uygulanan salmeterol ve flutikazon propiyonatın birbirlerinin farmakokinetiğini etkilediğine dair herhangi bir bulgu yoktur.
Bu nedenle farmakokinetik açıdan her iki bileşen ayrı ayrı düşünülebilir.
Salmeterol
Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazma konsantrasyonları gösterdiği için (yaklaşık 200 pg/ml veya daha az) plazmadaki ilaç miktarının tayini teknik olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadece sınırlı veriler bulunmaktadır.
Flutikazon propiyonat Emilim:
Sağlıklı gönüllülerde inhalasyon yoluyla alınan tek doz flutikazon propiyonatın mutlak biyoyararlanımı, kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-11'i arasında değişmektedir. Astımlı hastalarda inhale flutikazon propiyonata sistemik maruziyetin daha düşük düzeyde gözlenmiştir. Sistemik emilim temelde akciğerlerde meydana gelmekte olup ilk başta hızlı ve sonrasında uzun sürelidir. İ nhale dozun kalanı yutulabilir ancak düşük suda çözünürlük ve presistemik metabolizma nedeniyle sistemik maruziyete minimum katkıda bulunur ve oral biyoyararlanımının %1'den az olmasını sağlar. Sistemik maruziyet, inhale dozun artışıyla lineer şekilde artar.
Dağılım:
Flutikazon propiyonatın dispozisyonu, yüksek plazma klerensi (1150 ml/dak), kararlı durumda yüksek dağılım hacmi (300 L) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir.
Flutikazon propiyonatın plazma proteinlerine bağlanma oranı % 91'dir.
Biyotransformasyon:
Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite
metabolize edilir.
Eliminasyon:
Flutikazon propiyonat sistemik dolaşımdan çok hızlı temizlenir. Flutikazon propiyonatın renal klirensi önemsiz düzeydedir. Dozun %5'inden daha azı idrarda temelde metabolitler olarak atılmaktadır. Dozun büyük bir bölümü feçeste metabolitler ve değişmemiş olarak atılmaktadır.
Doğrusallık/Doğrusal olmayan durum:
BREQUAL'in doğrusallık/doğrusal olmayan durumu konusunda yeterli çalışma bulunmamaktadır.
Hastalardaki karakteristik özellikler Böbrek/Karaciğer yetmezliği:
Veri bulunmamaktadır.
Değişik yaş grupları
Pediyatrik popülasyon
4 ila 77 yaş arası 350 hastayı (hastaların 174'ü 4-11 yaş) içeren, farklı cihazların (orijinal cihaz, ölçülü inhalasyon cihazı) kullanıldığı, kontrol gruplarına yer verilen 9 çalışmadan bildirilen verilerin kullanıldığı bir popülasyon farmakokinetiği analizinde, flutikazon propiyonat 100 (orijinal cihaz) ile karşılaştırıldığında salmeterol/flutikazon propiyonat 50/100 ile tedavi sonrasında daha yüksek flutikazon propiyonat sistemik maruziyeti görülmüştür.
Çocuklarda ve Adölesan/Erişkin Popülasyonlarda flutikazon propiyonat (orijinal cihaz) karşısında Salmeterol/flutikazon propiyonat karşılaştırması için Geometrik Ortalama Oranı [%90 GA]
Tedavi (test karşısında referans) | Popülasyon | EAA | Cmaks |
Salmeterol/ flutikazon propiyonat 50/100 (orijinal cihaz) flutikazon propiyonat 100 (orijinal cihaz) | Çocuklar (4â11yaş) | 1,20 [1,06 â 1,37] | 1,25 [1,11 â 1,41] |
Salmeterol/ flutikazon propiyonat 50/100 (orijinal cihaz) flutikazon propiyonat 100 (orijinal cihaz) | Adölesan/Erişkin (â¥12 yaş) | 1,52 [1,08 â 2,13] | 1,52 [1,08 â 2,16] |
21 günlük salmeterol/flutikazon propiyonat inhaler 25/50 mikrogram (spacer ile birlikte veya spacer olmaksızın günde iki kez 2 inhalasyon) veya salmeterol/flutikazon propiyonat 50/100 mikrogram (orijinal cihaz) (günde iki kez 1 inhalasyon) tedavilerinin etkisi 4 ila 11 yaşlarında hafif astımlı 31 çocukta değerlendirilmiştir. Salmeterol/flutikazon propiyonat inhaler, spacer ile birlikte salmeterol/flutikazon propiyonat inhaler ve salmeterol/flutikazon propiyonat (orijinal cihaz) için salmeterol sistemik maruziyeti benzer olmuştur (sırasıyla 126pg sa/mL [%95 GA: 70, 225], 103pg sa/mL [%95 GA: 54, 200] ve 110 pg sa/mL [%95 GA: 55, 219]).
Flutikazon propiyonat sistemik maruziyeti spacer ile birlikte kullanılan salmeterol/flutikazon
propiyonat inhaler ile (107pg sa/mL [%95 GA: 45,7, 252,2]) ve salmeterol/flutikazon propiyonat (orijinal cihaz) (138pg sa/mL [%95 GA: 69,3, 273,2]) benzer olmştur, ancak salmeterol/flutikazon propiyonat inhaler için daha düşüktür (24pg sa/mL [%95 GA: 9,6, 60,2]).
5.3. Klinik öncesi güvenlilik verileri
Ayrı şekilde verilen salmeterol ve flutikazon propiyonatın hayvan çalışmaların insanlarda kullanıma yönelik güvenlilikle ilişkili tek endişe farmakolojik etkilerin artmasıyla ilişkili etkiler olmuştur.
Hayvan üreme çalışmalarında glukokortikoidlerin, malformasyonlara (yarık damak, iskelet bozuklukları) neden olduğu gösterilmiştir. Bununla birlikte bu hayvan deneylerinin önerilen dozların verildiği insanlar için anlamlı olduğu düşünülmemektedir. Salmeterol ksinafoat ile yapılan hayvan çalışmaları sadece yüksek maruziyet düzeylerinde embriyofetal toksisite göstermiştir. Birlikte uygulanımı takiben bilinen glukokortikoid kaynaklı anomalilerle ilişkilendirilen dozlarda sıçanlarda artan transpoze umblikal arter ve ossipital kemikte eksik osifikasyon insidansı tespit edilmiştir. Salmeterol ksinafoat veya flutikazon propiyonat genetik toksisite potansiyeli göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz (sığır sütünden elde edilir)
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklanmalıdır. Kuru bir yerde saklanmalıdır. Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
60 kapsüllük Alüminyum-Alüminyum blister ve Qhaler inhalasyon cihazı içeren karton kutularda satılmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tüm kullanılmayan ürün ve atık maddeler âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
BREQUAL akciğerlere inhale edilen bir toz salıvermektedir.
Qhaler inhalasyon cihazının kullanımı doktor ve eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içine yerleştirildikten sonra soluk alma yolu ile kullanılması gerektiği konusunda hasta
bilgilendirilmelidir. Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız ve boğaza küçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birden fazla delinmemesi ile en aza indirilir.
Qhaler cihazı, koruma kapağı çıkarılarak açılır ve kullanıma hazırlanır. Ağızlık ağıza yerleştirilir ve dudaklar etrafını saracak şekilde kapatılır. Bundan sonra doz inhale edilebilir ve koruma kapağı tekrar kapatılabilir.
Qhaler cihazının kullanım talimatları
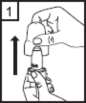
Qhaler cihazının kapağını çekerek çıkarın.
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AIRPLUS | 8680741520283 | |
| AIRPUFF | 8680741521129 | 268.56TL |
| AIRTIDE | 8680760150294 | 467.62TL |
| ASTER | 8699724550018 | |
| BELHALER | 8699540043770 | 507.94TL |
| Diğer Eşdeğer İlaçlar |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Abdi İbrahim İlaç Sanayi ve Ticaret A.Ş.
| Geri Ödeme Kodu | A14109 |
| Satış Fiyatı | 790.98 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 790.98 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699514550204 |
| Etkin Madde | Flutikazon + Salmeterol |
| ATC Kodu | R03AK06 |
| Birim Miktar | 500+50 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 60 |
| Solunum Sistemi > Adrenerjikler (İnhalan) > Salmeterol Kombinasyonları |
| Yerli ve Beşeri bir ilaçdır. |