XEPLION 100 mg/1 ml IM uzun salımlı süspansiyon içeren kullanıma hazır enjektör Klinik Özellikler
{ Paliperidon }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
XEPLION şizofreni tedavisi ve şizofreni semptomlarının tekrarının önlenmesinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji:XEPLION'un önerilen başlangıç dozu, terapötik konsantrasyonlara hızla ulaşılması amacıyla tedavinin birinci gününde 150 mg ve bir hafta sonra (8. gün) 100 mg'dır (her ikisi de deltoid kas içine uygulanır) (Bkz. Bölüm 5.2). Üçüncü doz, ikinci başlangıç dozdan bir ay sonra uygulanmalıdır. Önerilen aylık idame dozu 75 mg'dır. Önerilen 25 mg ila 150 mg'lık doz aralığında hastanın bireysel tolerabilitesine ve/veya etkililiğe göre bazı hastalar daha düşük ya da daha yüksek dozlardan yarar görebilir. İkinci dozu takiben aylık idame dozları deltoid veya gluteal kas içine uygulanabilir.
Uygulama sıklığı ve süresi:
İdame dozunun ayarlanması ayda bir yapılabilir. XEPLION'un uzatılmış salım özelliği doz ayarlaması yaparken göz önüne alınmalıdır (Bkz. Bölüm 5.2); çünkü idame dozlarının tam etkisi birkaç ay ortaya çıkmayabilir.
Uygulama şekli:
XEPLION, sadece intramüsküler kullanım için hazırlanmıştır. Farklı bir yoldan uygulanmamalıdır. Deltoid veya gluteal kas içine yavaş ve derin olarak enjekte edilmelidir. Her enjeksiyon bir sağlık uzmanı tarafından uygulanmalıdır. Uygulama tek bir enjeksiyon şeklinde yapılmalıdır. Doz, ayrı enjeksiyonlar şeklinde uygulanmamalıdır.
gün ve 8.gün başlangıç dozu hızla terapötik konsantrasyona ulaşmak amacıyla deltoid kas içine uygulanmalıdır. (Bkz. Bölüm 5.2). İkinci dozu takiben aylık idame dozları deltoid veya gluteal kas içine uygulanabilir. Enjeksiyon yerinde ağrı durumunda enjeksiyon yerindeki rahatsızlık iyi tolere edilemiyorsa gluteal kasından deltoid kasına (veya tam tersi) geçiş düşünülebilir. (Bkz. Bölüm 4.8). Ayrıca sağ ve sol taraf arasında alternatif değişim de tavsiye edilir.
4.3. Kontrendikasyonlar
Paliperidon palmitat veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir (Bkz. Bölüm 6.1).
Paliperidon, risperidonun aktif bir metaboliti olduğu için XEPLION risperidona karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Akut ajitasyon veya ciddi psikotik rahatsızlığı olan hastalarda kullanımı
XEPLION akut ajitasyon veya ciddi psikotik rahatsızlığı yönetmek için acil semptom kontrolü sağlanana kadar kullanılmamalıdır.
QT Aralığı
Diğer antipsikotiklerle olduğu gibi, bilinen kardiyovasküler hastalığı olan veya ailesinde QT uzama öyküsü olan hastalarda ve QT aralığını uzattığı düşünülen diğer ilaçlar ile birlikte kullanılacağı durumlarda, XEPLION reçetelenirken dikkatli olunmalıdır.
Nöroleptik malign sendrom
Hipertermi, kas rijiditesi, otonomik instabilite, bilinç değişikliği ve serum kreatinin fosfokinaz seviyelerinde yükselme ile karakterize olan nöroleptik malign sendrom'un (NMS), paliperidon ile oluştuğu bildirilmiştir. Ek klinik belirtiler arasında miyoglobülinüri (rabdomiyoliz) ve akut böbrek yetmezliği de bulunabilir. Eğer bir hastada NMS işaret eden bulgu ve semptomlar gelişirse, paliperidon kesilmelidir.
Tardif Diskinezi/ ekstrapiramidal semptomlar
Dopamin reseptör antagonisti özelliğine sahip ilaçlar, özellikle dil ve/veya yüzde, ritmik, istem dışı hareketlerle karakterize olan tardif diskinezinin indüksiyonu ile ilişkili bulunmuştur. Eğer tardif diskinezinin bulgu ve semptomları ortaya çıkarsa, XEPLION da dahil olmak üzere tüm antipsikotik ilaçların kesilmesi değerlendirilmelidir.
Psikostimulanlarla (örneğin metilfenidat) paliperidonu birlikte kullanan hastalarda, ilaçlardan birini veya her ikisini ayarlarken ekstrapiramidal semptomlar ortaya çıkabileceği için dikkatli olunmalıdır. Stimulan tedavisinin kademeli olarak kesilmesi önerilir (bkz. Bölüm. 4.5)
Lökopeni, Nötropeni ve Agranülositoz
XEPLION'la lökopeni, nötropeni ve agranülositoz olayları bildirilmiştir. Pazarlama sonrası izlemde agranülositoz çok nadiren (<1/10.000 hasta) bildirilmiştir.
Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş lökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bir düşüşe yönelik ilk belirtide XEPLION kullanımına son verilmesi düşünülmelidir.
Klinik olarak anlamlı nötropenisi olan hastalar ateş veya diğer enfeksiyon semptomları veya belirtileri açısından dikkatle izlenmeli ve bu tür semptomlar veya belirtilerin ortaya çıkması halinde derhal tedavi edilmelidir. Şiddetli nötropenisi olan hastalar (mutlak nötrofil sayımı <1 X 109/L) XEPLION kullanımına son vermeli ve iyileşene kadar WBC düzeylerini takip ettirmelidir.
Aşırı duyarlılık reaksiyonları
Daha önceden oral risperidon veya oral paliperidon ile tolere edilmiş hastalardaki anafilaktik reaksiyonlar pazarlama sonrası deneyim süresince nadiren rapor edilmiştir. (Bkz. Bölüm 4.1 ve 4.8).
Eğer anafilaktik reaksiyon meydana gelirse, XEPLION kullanımı kesilir, klinik olarak uygun şekilde genel destekleyici önlemler başlatılır ve belirti ve semptomlar kayboluncaya dek hasta izlenir.
Hiperglisemi ve diabetes mellitus
Hiperglisemi, diabetes mellitus ve diabetik koma ve ketoasidoz dahil olmak üzere önceden var olan diyabetin kötüleşmesi paliperidon tedavisi sırasında bildirilmiştir. Uygun klinik izlem, kullanılan antipsikotik kılavuz kurallarına uygun olarak tavsiye edilebilir. XEPLION ile tedavi edilen hastalarda hiperglisemi semptomları (örneğin polidipsi, poliüri, iştah ve halsizlik gibi) izlenmelidir ve diyabet hastaları glikoz kontrolünün kötüleşmesi açısından düzenli olarak izlenmelidir.
Prolaktine bağlı tümörü olan hastalarda kullanım
Doku kültürü çalışmaları meme tümörlerinde hücre büyümesinin prolaktin tarafından stimule edilebileceğini belirtmektedir. Klinik ve epidemiyolojik çalışmalarda antipsikotik kullanımı ile ilişkisi açık bir şekilde gösterilememiş olsa da, ilgili tıbbi öyküsü olan hastalarda dikkatli olunması önerilmektedir. Paliperidon prolaktine bağlı önceden var olan tümörü olan hastalarda dikkatli kullanılmalıdır.
Kilo alma
XEPLION kullanımıyla birlikte belirgin kilo alımı gözlenmiştir. Kilo düzenli olarak izlenmelidir.
Ortostatik hipotansiyon
Paliperidon, alfa-blokör aktivitesinden dolayı bazı hastalarda ortostatik hipotansiyonu indükleyebilir. Oral paliperidon uzatılmış salımlı tablet (INVEGA 3 mg, 6 mg, 9 mg ve 12 mg) ile yapılan plasebo kontrollü, 6 haftalık, sabit dozlu üç çalışmanın birleştirilmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'ine karşılık oral paliperidon ile tedavi edilen deneklerin %2,5'inde ortostatik hipotansiyon bildirilmiştir. XEPLION, bilinen kardiyovasküler hastalığı olan hastalarda (örn.; kalp yetmezliği, miyokart infarktüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden olabilecek durumlarda (örn.; dehidratasyon ve hipovolemi) dikkatli kullanılmalıdır.
Nöbetler
XEPLION, nöbet öyküsü olan hastalarda veya nöbet eşiğini potansiyel olarak düşüren diğer koşulların bulunduğu hastalarda dikkatli kullanılmalıdır.
Böbrek yetmezliği
Paliperidonun plazma konsantrasyonu, böbrek yetmezliği olan hastalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmektedir. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPLION önerilmez (Bkz. Bölüm 4.2 ve Bölüm 5.2).
Karaciğer yetmezliği
Ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) herhangi bir veri mevcut değildir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir.
Demansı olan yaşlı hastalar
Konvansiyonel ve atipik antipsikotik ilaçlar demansa bağlı psikozu olan yaşlı hastaların tedavisinde kullanıldığında ölüm riskinde artışa neden olmaktadır.
XEPLION demansı olan yaşlı hastalarda çalışılmamıştır. İnme için risk farktörlü demansı olan yaşlı hastalarda dikkatli kullanılmalıdır.
Aşağıda değinilen risperidon tecrübesi paliperidon için de düşünülebilir.
Genel mortalite
17 kontrollü klinik çalışmanın meta-analizinde, risperidon, aripiprazol, olanzapin ve ketiapin dahil olmak üzere diğer atipik antipsikotik ilaçlarla tedavi edilen ve demansı olan yaşlı hastalarda, mortalite riski plaseboya kıyasla artmıştır. Risperidon ile tedavi edilen hastalarda, plasebo için %3,1 olan mortalite %4 olmuştur.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
XEPLION'un QT aralığını uzattığı bilinen ilaçlar, örn.; sınıf IA antiaritmikler (örn.; kinidin, disopramid) ve sınıf III antiaritmikler (örn.; amiodaron, sotalol), bazı antihistaminikler, bazı diğer antipsikotik ilaçlar ve bazı antimalaryaller (örn.; meflokin) ile birlikte reçete ederken dikkatli olunması önerilir. Bu liste gösterge niteliğindedir ve ayrıntılı değildir.
XEPLION'un diğer ilaçları etkileme potansiyeli
Paliperidonun, sitokrom P-450 izoenzimleri ile metabolize olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olması beklenmemektedir.
Paliperidonun santral sinir sistemi üzerindeki primer etkileri ele alındığında (Bkz. Bölüm 4.8), XEPLION diğer santral etkili ilaçlar, örn.; anksiyolitikler, antipsikotiklerin çoğu, hipnotikler, opiatlar, vb. veya alkol ile birlikte dikkatli kullanılmalıdır.
Paliperidon, levodopa ve diğer dopamin agonistlerinin etkilerini antagonize edebilir. Bu kombinasyonun gerekli olduğuna karar verilirse, özellikle son evre Parkinson hastalığında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir.
Ortostatik hipotansiyonu indükleme potansiyeli nedeni ile (Bkz. Bölüm 4.4), XEPLION bu potansiyele sahip olan diğer terapötik ilaçlar, örn.; diğer antipsikotik ilaçlar, trisiklikler ile birlikte uygulandığı zaman aditif etki gözlenebilir.
Paliperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile birlikte kombine edilirse dikkatli olunması önerilir (yani fenotiyazinler veya butirofenonlar, trisiklikler veya selektif serotonin gerialım inhibitörleri (SSRI), tramadol, meflokin, vb.).
Kararlı durumdaki oral uzatılmış salımlı paliperidon tabletlerin (günde bir kez 12 mg) uzatılmış salımlı divalproeks sodyum tabletlerle (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproatın kararlı durum farmakokinetiğini etkilememiştir.
XEPLION ve lityum arasında etkileşim çalışması yapılmamıştır fakat farmakokinetik etkileşim olası değildir.
Diğer ilaçların XEPLION'u etkileme potansiyelleri
In vitro çalışmalar, CYP2D6 ve CYP3A4'ün paliperidon metabolizmasında minimal olarak görev aldığını gösterse de, bu izoenzimlerin, paliperidon metabolizmasında önemli bir rol oynadığına ilişkin in vitro veya in vivo bulgular yoktur.
Oral paliperidonun güçlü bir CYP2D6 inhibitörü olan paroksetinle birlikte uygulanması sonucu paliperidonun farmakokinetiği üzerinde klinik açıdan belirgin bir etki gözlenmemiştir.
Günde bir kere uygulanan uzatılmış salımlı oral paliperidonun günde iki kere 200 mg karbamazepin ile birlikte uygulanması, paliperidonun ortalama kararlı durum Cve EAA değerlerinde yaklaşık olarak %37 oranında bir düşüşe neden olmuştur. Bu düşüş, büyük ölçüde, karbamazepin tarafından renal P-gp'nin indüklenmesinin bir sonucu olarak paliperidonun renal klerensinde %35 oranında artışa bağlıdır. Karbamazepinin eş zamanlı olarak uygulanması esnasında, idrarla değişmeden atılan ilaç miktarında minör bir azalma, paliperidonun CYP metabolizması veya biyoyararlanımı üzerinde düşük derecede etki olduğunu düşündürmektedir. Karbamazepin dozu yükseldikçe paliperidonun plazma konsantrasyonu daha fazla düşer. Karbamazepin kullanımına başlandığında XEPLION dozu yeniden değerlendirilmeli ve gerekirse arttırılmalıdır. Bu durumun tersine, karbamazepin kullanımı kesildiğinde XEPLION dozu yeniden değerlendirilmeli ve gerekirse azaltılmalıdır.
12 mg oral uzatılmış salımlı paliperidon tabletin tekli bir dozunun, uzatılmış salımlı divalproeks sodyum tabletlerle (günde bir kez iki 500 mg'lık tablet) eşzamanlı olarak uygulanması
muhtemelen artmış oral absorpsiyonun bir sonucu olarak paliperidonun Cve EAA'sında yaklaşık %50'lik bir artışla sonuçlanmıştır. Sistemik klerenste herhangi bir etki gözlenmediğinden, uzatılmış salımlı divalproeks sodyum tabletler ve XEPLION'un intramüsküler enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemektedir. Bu etkileşim XEPLION ile çalışılmamıştır.
XEPLION'un risperidon veya oral paliperidon ile birlikte kullanımı
Paliperidon risperidonun majör aktif metaboliti olduğundan, XEPLION ile risperidon veya oral paliperidon uzun süre için eş zamanlı kullanılacağı zaman dikkatli olunmalıdır. XEPLION âun diğer antipsikotikler ile birlikte kullanımı ile ilgili güvenlilik bilgileri sınırlıdır.
XEPLION'nun psikostimülanlarla birlikte kullanımı
Psikostimülanların (örn., Metilfenidat) paliperidon ile birlikte kullanımı, tedavilerin birinde ya da her ikisinde de değişiklik yapıldığında ekstrapiramidal semptomlara yol açabilir (bkz. Bölüm 4.4).
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
XEPLION'un çocuk doğurma potansiyeli bulunan kadınlarda kontrasepsiyon gerekliliğine işaret edecek yeterli bilgi mevcut değildir.
Gebelik dönemi
XEPLION'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
İntramüsküler enjekte edilen paliperidon palmitat veya oral uygulanan paliperidon hayvan çalışmalarında teratojen bulunmamıştır ama diğer üreme toksisitesi türleri görülmüştür (bkz. Bölüm 5.3).
Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (paliperidon da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretler/ekstrapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altındadırlar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiratuvar distres veya beslenme bozukluklarını içermektedir. Bu nedenle yeni doğanlar dikkatle izlenmelidir. XEPLION, kesin gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Paliperidon terapötik dozda emziren kadınlara uygulandığı takdirde anne sütüne geçtiği için bebek üzerine etkileri muhtemeldir.
XEPLION emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/Fertilite
Non-klinik çalışmalarda ilgili herhangi bir etki gözlenmemiştir. Fakat üreme toksitesinin diğer tipleri görülmüştür (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Paliperidonun sedasyon, somnolans, senkop ve bulanık görme gibi potansiyel görsel ve sinir sistemi üzerindeki etkilerinden dolayı araç ve makine kullanımı üzerinde hafif veya orta derecede etkiye sahiptir. (Bkz. Bölüm 4.8) Bu nedenle hastalar, XEPLION'a karşı bireysel duyarlılıkları bilinene kadar araç veya makine kullanmamaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Klinik çalışmalarda en sık bildirilen advers ilaç reaksiyonları (ADR'ler) insomnia, baş ağrısı, anksiyete, kilo alımı, enjeksiyon bölgesi reaksiyonları, parkinson, ajitasyon, somnolans/ sedasyon, akatizi, bulantı, konstipasyon, sersemlik, kas iskelet sistemi ağrıları, tremor, abdominal ağrı, yorgunluk, distoni, kusma, üst solunum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonları arasından akatizi ve sedasyon/ somnolans dozla ilişkili olarak ortaya çıkmaktadır.
Aşağıda verilen tüm ADR'ler klinik çalışmalarda paliperidon palmitat ile tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sıklık dereceleri kullanılmıştır:
Çok yaygın (≥1/10); yaygın (â¥1/100 ile <1/10); yaygın olmayan (â¥1/1,000 ile <1/100); seyrek (â¥1/10,000 ile <1/1,000); çok seyrek (<1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Sistem Organ Sınıfı | Advers İlaç Reaksiyonları |
| |||
Sıklık |
| ||||
Çok yaygın |
Yaygın |
Yaygın Olmayan |
Seyrek | Bilinmiyor | |
Enfeksiyonlar ve enfestasyonlar |
| Üst solunum yolu enfeksiyonu, idrar yolu enfeksiyonu, grip | Pnömoni, bronşit, solunum sistemi enfeksiyonu, sinüzit, sistit, kulak enfeksiyonu, tonsillit,tırnak mantarı, selülit | Göz enfeksiyonu, akarodermatit, deri altı apsesi |
|
Kan ve lenf sistemi hastalıkları |
|
| Beyaz kan hücresi sayısında azalma, trombositopeni, anemi, | Nötropeni, | Agranülositoz |
Bağışıklık sistemi hastalıkları |
|
| Hipersensitivite |
| Anafilaktik reaksiyon |
Endokrin hastalıkları |
| Hiperprolak- tinemi |
| Uygunsuz antidiüretik hormon salgılama, idrarda glukoz bulunması |
|
Metabolizma ve beslenme hastalıkları |
| Hiperglisemi, kilo alımı, kilo kaybı, iştah kaybı | Diabetes mellitus, hiperinsülinemi, iştah artışı, anoreksi,kan trigliserid düzeyinde yükselme, kan kolesterol düzeyinde yükselme | Diyabetik ketoasidoz, hipoglisemi, polidipsi, | Su intoksikasyonu |
Psikiyatrik hastalıklar | İnsomnia | Ajitasyon, depresyon, anksiyete | Kabus, mani, libido azalması, sinirlilik, uyku bozuklukları | Katatoni, konfüzyonal durum, uyurgezerlik, duyguda küntleşme, orgazm olamama | uyku ile ilişkili yeme bozukluğu |
Sinir sistemi hastalıkları |
| Distoni, parkinsonizm , akatizi, diskinezi, tremor, sersemlik, somnolans/ sedasyon, baş ağrısı | Tardif diskinezi, senkop, psikomotor hiperaktivite, postural sersemlik, dikkat bozukluğu, disartri, disguzi, hipoestezi, parestezi | Nöroleptik malign sendrom, serebral iskemi, uyaranlara yanıt vermeme, bilinç kaybı, deprese bilinç düzeyi, konvülsiyon, denge bozukluğu, anormal koordinasyon | Diyabetik koma, baş titremesi |
Göz hastalıkları |
|
| Bulanık görme, konjunktivit, göz kuruluğu | Glokom, göz hareket bozukluğu, göz kayması, fotofobi, göz yaşarmasında artma, oküler hiperemi | Intraoperatif gevşek (floppy ) iris sendromu |
Kulak ve iç kulak hastalıkları |
|
| Vertigo, kulak çınlaması, kulak ağrısı |
|
|
Kardiyak hastalıklar |
| Taşikardi | Atrioventriküler blok, iletim bozukluğu, elektrokardiyogra mda QT uzaması, postural ortostatik taşikardi sendromu, bradikardi, normal olmayan elektrokardiyogra m, palpitasyonlar | Atriyal fibrilasyon, sinüs aritmi |
|
Vasküler hastalıklar |
| Hipertansi- yon | Ortostatik hipotansiyon, hipotansiyon | Venöz tromboz, kızarma | Akciğer embolisi , iskemi |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar |
| Öksürük, burun tıkanıklığı | Dispne, solunum sistemi tıkanıklığı, hırıltılı solunum, faringolaringeal ağrı, burun kanaması | Uyku apnesi sendromu, pulmoner tıkanıklık, raller | Hiperventilas- yon, pnömoni aspirasyon, disfoni |
Gastrointesti- nal hastalıklar |
| Abdominal ağrı, kusma, bulantı, konstipasyon, diyare, dispepsi, diş ağrısı | Abdominal rahatsızlık, gastroenterit, yutma güçlüğü, ağız kuruluğu, midede veya bağırsakta gaz birikimi | Pankreatit, şişmiş dil, fekal enkontinans, fekalom, dudak iltihabı | Bağırsak tıkanıklığı, ileus |
Hepato-bilier hastalıklar |
| Transaminaz artışı | Gama- glutamiltransferaz artışı, hepatik enzim artışı |
| Sarılık |
Deri ve deri altı doku hastalıkları |
|
| Ürtiker, kaşıntı, döküntü, alopesi, egzama, kuru cilt, eritem, akne |
İlaç döküntüsü, hiperkeratozis, kepek | Stevens-Johnson sendromu / toksik epidermal nekroliz, anjiyoödem, deride renk değişikliği, seboreik dermatit |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları |
| Kas-iskelet ağrısı, sırt ağrısı, artralji | Kan kreatin fosfokinaz düzeyinde artış, duruş anormalliği, kas spazmları, eklem sertliği, kas zayıflığı, boyun ağrısı | Rabdomiyoliz, eklem şişliği | Duruş anomalisi |
Böbrek ve idrar yolu hastalıkları |
|
| İdrar tutamama, pollaküri, dizüri | İdrar retansiyonu |
|
Gebelik, pueperiyum durumları ve perinatal hastalıkları |
|
|
|
| Neonatal ilaç yoksunluk sendromu (Bkz Bölüm 4.6) |
Üreme sistemi ve meme hastalıkları |
| Amenore, galaktore | Erektil disfonksiyon, boşalma bozukluğu, menstrual bozukluk, jinekomasti, seksüel disfonksiyon, meme ağrısı | Meme rahatsızlığı, meme dolgunluğu, meme büyümesi, vajinal akıntı | Priapizm |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
| Yüksek ateş, asteni, yorgunluk, enjeksiyon bölgesinde reaksiyon | Yüzde ödem, ödem, vücut sıcaklığında artış, anormal yürüme, göğüs ağrısı, göğüste rahatsızlık hissi, kırıklık, indürasyon | Hipotermi, titreme, susuzluk, ilaç yoksunluk sendromu, enjeksiyon yerinde apse, enjeksiyon bölgesinde selülit, enjeksiyon bölgesinde kist, enjeksiyon bölgesinde hematom | Vücut sıcaklığında azalma,enjeksiy on yerinde nekroz, enjeksiyon yerinde ülser |
Yaralanma, zehirlenme ve prosedürel komplikas- yonlar |
|
| Düşme |
|
|
aAdvers reaksiyonların paliperidon palmitat klinik çalışmalarında gözlenmemesi sebebiyle bu reaksiyonların sıklığı â'bilinmiyor'' şeklinde belirtiliyor. Bu advers reaksiyonlar ya spontane pazarlama sonrası raporlardan kaynaklanıyor ve sıklığı belirlenemedi, ya da risperidon (herhangi bir formülasyon) veya oral paliperidon klinik deney verilerinden ve/veya pazarlama sonrası raporlardan kaynaklanıyor.
b Aşağıda 'Hiperprolaktinemi' bakınız.
cAşağıda 'Ekstrapiramidal semptomlar' bakınız.
dPlasebo-kontrollü çalışmalarda, XEPLION ile tedavi edilen kişilerde diyabet, plasebo grubunda %0,39 oran ile karşılaştırılırsa %0,32 oranında bildirilmiştir. Tüm klinik çalışmalardan elde edilen toplam insidans paliperidon palmitat ile tedavi edilen kişilerde % 0,65 olmuştur.
eİnsomnia: Uykuyu başlatma, sürdürme güçlüğü, konvülziyon: grand mal konvülziyon; Ödem: genel ödem, periferal ödem gode bırakan ödem. Adet bozukluğu: adet gecikmesi, düzensiz adet, oligomenore
Risperidon formülasyonları ile belirlenen istenmeyen etkiler:
Paliperidon risperidonun aktif metabolitidir; bu nedenle bu bileşiklerin (oral ve enjektabl formülasyonların ikisi de dahil olmak üzere) advers etki profilleri birbiri ile ilişkilidir.
Seçilen advers etkilerin açıklanması
Anafilaktik reaksiyon
Nadiren, XEPLION ile enjeksiyondan sonra anafilaktik reaksiyon vakaları, daha önce oral risperidon veya paliperidonu tolere etmiş hastalarda pazarlama sonrası deneyim sırasında bildirilmiştir (bakınız bölüm 4.4).
Enjeksiyon yerinde reaksiyonlar
Enjeksiyon bölgesinde en sık bildirilen advers etki ağrıdır. Bu reaksiyonların çoğu hafif ila orta şiddettedir. XEPLION ile bütün faz 2 ve faz 3 klinik çalışmalarında, enjeksiyon bölgesi ağrısının bireysel algısı zamanla sıklık ve yoğunluğu azaltmayı amaçlayan görsel analog skalada değerlendirmiştir. Deltoid enjeksiyonlar gluteal enjeksiyonlara oranla biraz daha fazla ağrılı olarak algılanmıştır. Diğer enjeksiyon bölgesi reaksiyonları çoğunlukla hafif yoğunluktadır ve enjeksiyon bölgesinde sertleşme (yaygın), kaşıntı (yaygın olmayan) ve nodüller (seyrek) olarak tanımlanmıştır.
Ekstrapiramidal semptomlar (EPS)
EPS belirtilen semptomların bir arada olduğu toplu analizin sonucudur. Bunlar, parkinsonizm (tükrük hipersekresyonu, kas-iskelet sertliği, parkinsonizm, salya artışı, dişliçark bulgusu, bradikinezi, hipokinezi, maskeli yüz, kas gerginliği, akinezi, ense sertliği, kas sertliği, parkinson yürüyüşü, anormal glabellar refleks, parkinsona özgü istirahat tremoru), akatizi (akatizi, huzursuzluk, hiperkinezi, ve huzursuz bacak sendromu), diskinezi (diskinezi, kas çekilmesi, koreoatetoz, atetoz ve kas seyirmesi), distoni (distoni, hipertoni, tortikollis, istemsiz kas kasılmaları, kas kontraktürü, blefarospazm, okülojiri, dil felci, yüz spazmı, laringospazm, miyotoni, opistotonus, orofaringeal spazm, plörototonus, dil spazmı ve trismus) ve tremordur. Semptomların geniş bir spektrumunun, mutlak bir ekstrapiramidal kökene sahip olmadığına dikkat edilmelidir.
Kilo alma
150 mg'lık başlangıç dozunun kullanıldığı 13 haftalık çalışmada, vücut ağırlığının %7'si ve daha fazla kilo alma kriterini karşılayan bireylerin oranları, XEPLION gruplarında plasebo grubuna göre daha yüksek orandadır. %7 ve daha fazla anormal kilo alımı olan denek oranı, dozla ilişkili bir eğilim göstermiştir ve insidans oranı plasebo grubunda %5 iken; XEPLION 25 mg, 100 mg ve 150 mg gruplarında plasebo ile karşılaştırmalı olarak sırasıyla %6, %8 ve %13 bulunmuştur.
Uzun dönemde nüksü önleme çalışmasının 33 haftalık açık etiketli geçiş/idame dönemi esnasında, XEPLION ile tedavi edilen deneklerin %12'si bu kritere uymuştur (çift-kör fazından son noktaya kadar â¥%7 kilo artışı); açık etiketli başlangıca göre ortalama (SD) ağırlık değişikliği +0.7 ( 4,79) kg olmuştur.
Hiperprolaktinemi
XEPLION alan deneklerde her iki cinsiyette de, serum prolaktin düzeyinde ortalama artışlar gözlenmiştir. Prolaktin düzeylerinde artışı düşündürebilecek advers olaylar (örn.; amenore, galaktore, jinekomasti, menstrüal bozukluklar) genel olarak deneklerin %1'inden azında bildirilmiştir.
Sınıf etkileri
Antipsikotik ilaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik ölüm, kardiyak arrest ve Torsades de pointes görülebilir.
Pulmoner embolizm ve derin ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir (sıklık bilinmemektedir).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Genellikle, beklenen bulgu ve semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşukluk ve sedasyon, taşikardi ve hipotansiyon, QT uzaması ve ekstrapiramidal semptomlardır. Torsade de pointes ve ventriküler fibrilasyon, oral paliperidon ile doz aşımı ayarında rapor edilmiştir. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir.
Tedavi gereksinimleri ve iyileşme değerlendirilirken XEPLION'un uzatılmış salım özelliği ve paliperidonun uzun yarılanma ömrü göz önünde tutulmalıdır. Paliperidonun spesifik bir antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı, korunmalı ve yeterli oksijenasyon, ventilasyon sağlanmalıdır. Kardiyovasküler izlemeye hemen başlanmalı ve olası aritmiler için sürekli elektrokardiyografik izleme yapılmalıdır. Hipotansiyon ve dolaşım kollapsı, intravenöz sıvı ve/veya sempatomimetik ilaçlar gibi uygun önlemlerle tedavi edilmelidir. Ciddi ekstrapiramidal semptomların varlığında antikolinerjik ilaçlar uygulanmalıdır. Hasta iyileşene kadar yakın denetim ve gözlem sürdürülmelidir.
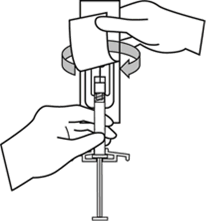
Güvenlik iğnesinin kabını yarıya kadar sıyırınız. Plastik sıyırma kabını kullanarak iğne kılıfını kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağlantısına saat yönünde çevirerek takınız.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Geri Ödeme Kodu | A13601 |
| Satış Fiyatı | 2914.89 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 2914.89 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593950063 |
| Etkin Madde | Paliperidon |
| ATC Kodu | N05AX13 |
| Birim Miktar | 100+1 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Sinir Sistemi > Antipsikotikler > Paliperidon |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |