OPDIVO 40 mg/4ML IV inf. çöz. kons. içeren 1 flakon Kısa Ürün Bilgisi
{ Nivolumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
OPDIVO® 40 mg/4 mL IV infüzyonluk çözelti konsantresi içeren flakon Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her 1 mL konsantre 10 mg nivolumab içerir.
4 mL konsantre içeren 1 flakon 40 mg nivolumab içerir.
Nivolumab, rekombinant DNA teknolojisi ile Çin hamsteri over hücrelerinde üretilen tamamen insana özgü bir anti-PD-1 monoklonal antikordur (IgG4).
Yardımcı maddeler
Sodyum sitrat dihidrat Sodyum klorür
Sodyum hidroksit (pH ayarlaması için)
Her 1 mL konsantre 0,1 mmol (veya 2,5 mg) sodyum içerir. Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyonluk çözelti konsantresi (steril konsantre)
Az sayıda partikül içerebilen, berrak ila opak, renksiz ila açık sarı likittir. Çözeltinin pH değeri yaklaşık 6 ve ozmolaritesi yaklaşık 340 mOsm/kg'dır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Adjuvan Melanom
OPDIVO, monoterapi olarak tam rezeksiyon uygulanmış ve lenf düğümü tutulumu olan yetişkinlerde adjuvan tedavi için endikedir. OPDIVO ile tedavi edilmiş hastalar, hastalık progresyonu halinde PD-1, PDL-1 ve CTLA-4 inhibitörü kullanamazlar. Tedavi süresi 12 ay ile sınırlıdır. (bkz. Bölüm 5.1)
Melanom
OPDIVO monoterapi veya ipilimumab ile kombinasyon halinde ECOG performans durumu 0-1 olan yetişkinlerde ileri evre (rezeke edilemeyen veya metastatik) melanom tedavisinde endikedir.
Renal Hücreli Karsinom (RHK)
OPDIVO, berrak hücreli kanser içeren renal kanserli ileri evre yetişkin hastalarda endikedir. Hastaların karnofsky performans statüsü en az 70 olmalıdır. Daha önce bir veya iki basamak antianjiojenik tedavi ve en fazla 3 basamak sistemik tedavi uygulanmış olması ve hastalık progresyonu görülmüş olmalıdır.
OPDIVO, ipilimumab ile kombinasyon halinde IMDC risk kategorisi orta/kötü riskli, Karnofsky Performans Durumu 70 ve üzerinde olan ve 65 yaş ve altındaki ileri evre renal hücreli karsinomlu yetişkin hastaların birinci basamak tedavisinde endikedir (bkz. Bölüm 5.1).
Klasik Hodgkin Lenfoma (cHL)
OPDIVO, nüks veya refrakter klasik Hodgkin Lenfoma görülen yetişkin hastalarda; otolog kök hücre nakli (OKHN) ve brentuksimab vedotin tedavisinden sonra, veya OKHN de dahil olmak üzere en az 3 basamak sistemik tedavi sonrasında monoterapi olarak endikedir.
Küçük Hücreli Dışı Akciğer Kanseri (KHDAK)
OPDIVO, ipilimumab ve 2 kür platin bazlı kemoterapi ile kombinasyon halinde, EGFR mutasyonu veya ALK translokasyonu bulunmayan metastatik küçük hücreli dışı akciğer kanserli ECOG performans skoru 0-1 olan yetişkin hastaların birinci basamak tedavisinde endikedir.
OPDIVO, performans durumu ECOG 0-1 olan, ve bilinen EGFR, ALK, ROS mutasyonu ve/veya semptomatik beyin metastazı olmayan, lokal ileri/metastatik küçük hücreli dışı akciğer kanseri (KHDAK) olup, daha önce bir basamak kemoterapi kullanımından sonra progresyon gelişen hastaların tedavisinde, tekrar progresyona kadar kullanımı endikedir. (Bu hastaların tedavisinde tedavi öncesi veya sonrasında başka bir PD-1/PD-L1 inhibitörü kullanılamaz.)
Malign Plevral Mezotelyoma (MPM)
OPDIVO, ipilimumab ile kombinasyon halinde, rezeke edilemeyen malign plevral mezotelyoması olan yetişkin hastaların birinci basamak tedavisinde endikedir.
Skuamöz Hücreli Baş ve Boyun Kanseri (SHBBK)
Opere edilemeyen lokal ileri evre kemoradyoterapi sonrası nüks gelişen veya metastatik baş boyun (oral kavite, farenks, larenks) yassı epitel hücreli kanserlerde birinci basamak platin temelli kemoterapi sonrası ilk 6 ay içerisinde nüks gelişen hastaların tedavisinde progresyona kadar kullanımı uygundur.
Mikrosatellit İnstabilitesi Yüksek (MSI-H) veya Uyumsuzluk Onarım Eksikliği (dMMR) olan Metastatik Kolorektal Kanser (mKRK)
Nivolumab, monoterapi olarak, bir fluoropirimidin, oksaliplatin ve irinotekan ile tedaviyi takiben progresyon gösteren mikrosatellit instabilitesi yüksek (MSI-H) ya da uyumsuzluk onarım eksikliği (dMMR) olan metastatik kolorektal kanseri (mKRK) olan yetişkin hastaların tedavisinde endikedir.
Özofagus Skuamöz Hücreli Karsinom (ÖSHK)
OPDIVO, metastatik veya küratif tedaviye uygun olmayan lokal ileri özofagus skuamöz hücreli karsinomu bulunan yetişkin hastaların tedavisinde floropirimidin ve platin bazlı kombinasyon kemoterapisine progresyon gelişen hastalarda monoterapi olarak endikedir.
Özofagus Kanseri (ÖK) veya Gastroözofageal Bileşke Kanserinin (GEJC=GBK) Adjuvan Tedavisi
OPDIVO monoterapi olarak, önceki neoadjuvan kemoradyoterapi ve küratif cerrahi tedavileri sonrasında patolojik rezidüel hastalığı bulunan özofagus veya gastroözofageal bileşke kanseri olan yetişkin hastaların adjuvan tedavisinde nükse kadar veya maksimum 1 yıl süreyle endikedir. (bkz. Bölüm 5.1).
Mide Adenokanseri (MK), Gastroözofageal Bileşke (GEJ=GBK) Kanseri veya Özofagus Adenokarsinom (ÖAK)
OPDIVO, fluoropirimidin ve platin içeren kemoterapi rejimi ile kombinasyon halinde, PD-L1 kombine pozitif skoru (CPS) ≥ 5 olup, HER2-negatif, ECOG 0-1, rezeke edilemeyen ileri evre/metastatik mide kanseri, gastroözofageal bileşke kanseri veya özofagus adenokarsinomu olan yetişkin hastaların birinci basamak tedavisi için endikedir. Hastalar eğer neoadjuvan/adjuvan tedavi aldılarsa en az 6 aylık hastalıksız süre geçmiş olmalıdır.
4.2. Pozoloji ve uygulama şekli
Tedavi, kanser tedavisinde deneyimli uzman doktorlar tarafından başlatılmalı ve kontrol edilmelidir.
PD-L1 testi
Eğer endikasyonda belirtilmişse, OPDIVO tedavisi için hasta seçimi PD-L1'in tümör ekspresyonuna dayalı olarak, valide edilmiş bir testle doğrulanmalıdır (bkz. Bölüm 4.1, 4.4 ve 5.1).
Pozoloji/uygulama sıklığı ve süresi
OPDIVO'nun monoterapi olarak önerilen dozu 2 haftada bir 60 dakikalık intravenöz infüzyonla verilen 3 mg/kg'dir. Tedavi, klinik yarar gözlendiği sürece veya tedavi hasta tarafından artık tolere edilemeyinceye kadar sürdürülmelidir.
MSI-H/dMMR mKRK için, monoterapi olarak önerilen OPDIVO dozu, hastalık progresyonu veya kabul edilemez toksisiteye kadar 30 dakika süreyle intravenöz infüzyon olarak 2 haftada bir uygulanan 240 mg'dır.
Özofagus Skuamöz Hücreli Karsinom (ÖSHK) için, monoterapi olarak önerilen OPDIVO dozu, 2 haftada bir 30 dakika süreyle intravenöz infüzyon olarak uygulanan 240 mg veya 2 haftada bir 60 dakikalık intravenöz infüzyon olarak uygulanan 3 mg/kg'dir.
Adjuvan tedavi için OPDIVO ile tedavi süresi maksimum 12 aydır.
İpilimumab ile kombinasyon halinde OPDIVO Melanom
Önerilen doz, ilk 4 doz için 3 haftada bir intravenöz yoldan uygulanan 3 mg/kg ipilimumab ile kombinasyon halinde 1 mg/kg nivolumab şeklindedir. Tablo 1'de gösterildiği üzere, bunu, her 2 haftada bir 240 mg veya her 4 haftada bir 480 mg dozda intravenöz yoldan uygulanan nivolumab monoterapisi fazı takip eder. Monoterapi fazında, ilk nivolumab dozu aşağıda gösterilen şekillerde uygulanmalıdır;
Her iki haftada bir 240 mg uygulanıyor ise, nivolumab ve ipilimumab kombinasyonunun son dozundan 3 hafta sonra ya da
4.3. Kontrendikasyonlar
Etkin madde
OPDIVO 18 yaşın altındaki hastalarda kullanılmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
PD-L1 durumunun değerlendirilmesi
Tümörün PD-L1 durumunu değerlendirirken, iyi valide edilmiş ve güçlü bir metodolojinin kullanılması önemlidir.
Immün ilişkili advers reaksiyonlar
Nivolumab kombinasyon halinde uygulandığında, tedavinin başlangıcından önce diğer kombinasyon tedavisi bileşenlerinin Kısa Ürün Bilgisi'ne bakınız. İmmün ilişkili advers reaksiyonlar, monoterapi olarak nivolumaba kıyasla ipilimumab ile kombinasyon halinde nivolumab tedavisi ile daha fazla meydana gelmiştir. İmmün ilişkili advers reaksiyonların birçoğu kortikosteroid tedavisinin başlatılması ve tedavi değişiklikleri dahil olmak üzere uygun yönetim adımları ile iyileşmiş ya da çözülmüştür (bkz. Bölüm 4.2).
Vücutta birden fazla sistemi etkileyen bağışıklıkla ilgili advers reaksiyonlar aynı anda meydana gelebilir.
Kombinasyon tedavisinde pulmoner emboli dahil olmak üzere kardiyak ve pulmoner advers olaylar da bildirilmiştir. Hastalar tedavi öncesinde ve tedavi sırasında periyodik olarak elektrolit bozukluklarının ve dehidratasyonun göstergesi olan klinik bulgular, semptomlar ve laboratuvar anormalliklerinin yanı sıra, kardiyak ve pulmoner advers reaksiyonlar için sürekli izlenmelidir. İpilimumab ile kombinasyon halinde nivolumab uygulaması yaşamı tehdit eden ya da tekrarlayan şiddetli kardiyak ve pulmoner advers reaksiyonların meydana gelmesi halinde kesilmelidir (bkz. Bölüm 4.2).
Nivolumab, immün ilişkili advers reaksiyonlarla ilişkilendirilmiştir.
Nivolumab tedavisi sırasında veya tedaviden sonraki herhangi bir zamanda bir advers reaksiyon meydana gelebileceğinden, hastalar sürekli olarak izlenmelidir (son dozu takiben en az 5 ay).
Şüpheli immün ilişkili advers reaksiyonlar için, etiyolojiyi doğrulamak veya diğer nedenleri dışlamak için uygun değerlendirmeler yapılmalıdır. Advers reaksiyonun şiddetine dayanarak, nivolumab tedavisi kesilmeli ve kortikosteroidler uygulanmalıdır. Bir advers reaksiyon nedeniyle uygulanan kortikosteroid, iyileşme sonrasında en az 1 aylık sürede azaltılarak kesilmelidir. Dozun kısa sürede kesilmesi advers reaksiyonun kötüleşmesine veya tekrarlamasına yol açabilir. Kortikosteroid kullanımına rağmen kötüleşme görülen veya iyileşme görülmeyen hastalarda kortikosteroid dışında bir immünosupresif tedavi eklenmelidir.
Hasta, immünosupresif kortikosteroid dozlarını ya da diğer immünosüpresif tedavileri alırken nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden başlatılmamalıdır. İmmünosüpresif tedavi alan hastalarda fırsatçı enfeksiyonların önlenmesi için profilaktif antibiyotikler kullanılmalıdır.
Herhangi bir şiddette immün ilişkili advers reaksiyonun tekrarlaması veya yaşamı tehdit eden herhangi bir immün ilişkili reaksiyon görülmesi durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
İmmün ilişkili pnömonit
Nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi sırasında şiddetli pnömonit veya ölümcül vakalar dahil olmak üzere interstisyel akciğer hastalığı gözlenmiştir (bkz. Bölüm 4.8). Hastalar radyografik değişiklikler (örn., fokal buzlu cam opasiteleri ve yama tarzında filtratlar), dispne ve hipoksi gibi pnömonit işaretleri ve semptomları açısından izlenmelidir. Enfeksiyöz ve hastalıkla ilişkili etiyolojiler dışlanmalıdır.
Derece 3 veya 4 pnömonit için nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmeli ve 2 ila 4 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır.
Derece 2 (semptomatik) pnömonit için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve 1 mg/kg/gün metilprednizolon eşdeğeri kortikosteroid tedavisine başlanmalıdır. İyileşmeden sonra, kortikosteroid tedavisinin kademeli olarak kesilmesini takiben nivolumab tedavisi yeniden başlatılabilir. Kortikosteroid tedavisine başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 2 ila 4 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
İmmün ilişkili kolit
Nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi ile şiddetli diyare ya da kolit gözlenmiştir (bkz. Bölüm 4.8). Hastalar diyare ya da karın ağrısı ve dışkıda mukus veya kan gibi ilave kolit semptomları için izlenmelidir. Kortikosteroide yanıtsız immün ilişkili kolit hastalarında sitomegalovirüs (CMV) enfeksiyonu/reaktivasyonu bildirilmiştir. Enfeksiyöz ve hastalıkla ilişkili etiyolojiler dışlanmalıdır, Bu nedenle uygun laboratuvar testleri ve ek incelemeler yapılmalıdır. Eğer kortikosteroide yanıtsız immün ilişkili kolit tanısı doğrulanmışsa kortikosteroid tedavisine alternatif bir immünosüpresif ilaç eklenmesi ya da kortikosteroid tedavinin değiştirilmesi düşünülmelidir.
Derece 4 diyare ya da kolit için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmeli ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır.
Derece 3 diyare ya da kolit için nivolumab monoterapi tedavisine ara verilmeli ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben nivolumab tedavisi yeniden başlatılabilir. Kortikosteroid tedavisine başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse, nivolumab monoterapi tedavisi kalıcı olarak kesilmelidir. Nivolumab monoterapisi ya da ipilimumab ile kombinasyon halinde nivolumab tedavisinde, tedavinin kalıcı olarak kesilmesini ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozlarda kortikosteroidlerin başlatılmasını gerektiren Derece 3 diyare ya da kolit gözlemlenmiştir.
Derece 2 diyare ya da kolit için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmelidir. Persistan diyare veya kolit için, 0,5 ila 1 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisi kullanılmalıdır. İyileşmeden sonra, kortikosteroid tedavisinin kademeli olarak kesilmesini takiben gerekirse nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden başlatılabilir. Kortikosteroid tedavisine başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 1 ila 2 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
İmmün ilişkili hepatit
Nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi ile şiddetli hepatit gözlenmiştir (bkz. Bölüm 4.8). Hastalar, transaminaz ve toplam bilirubin düzeylerinde yükselme gibi hepatit belirti ve semptomları için izlenmelidir. Enfeksiyöz ve hastalıkla ilişkili etiyolojiler dışlanmalıdır.
Transaminaz ve toplam bilirubin düzeylerinde Derece 3 veya 4 artış durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmeli ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır.
Derece 2 transaminaz veya toplam bilirubin artışı durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmelidir. Bu laboratuvar değerlerinde persistan artış için, 0,5 ila 1 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisi kullanılmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben gerekirse nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden başlatılabilir. Kortikosteroid tedavisine başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 1 ila 2 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
İmmün ilişkili nefrit ve renal fonksiyon bozukluğu
Nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi ile şiddetli nefrit veya böbrek fonksiyon bozukluğu gözlenmiştir (bkz. Bölüm 4.8). Hastalar, nefrit ve böbrek fonksiyon bozukluğu belirti ve semptomları için izlenmelidir. Hastaların çoğunda herhangi bir semptom olmadan serum kreatininde artış gözlenmiştir. Hastalıkla ilişkili etiyolojiler dışlanmalıdır.
Derece 4 serum kreatinin artışları için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmeli ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozunda kortikosteroid tedavisine başlanmalıdır.
Derece 2 veya 3 serum kreatinin artışı için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve 0,5 ila 1 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden başlatılabilir. Kortikosteroid tedavisine başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 1 ila 2 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
İmmün ilişkili endokrinopatiler
Nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi ile hipotiroidizm, hipertiroidizm, adrenal yetmezlik (sekonder adrenokortikal yetmezlik dahil), hipofizit (hipopitüitarizm dahil), diabetes mellitus ve diyabetik ketoasidoz dahil şiddetli endokrinopatiler gözlenmiştir (bkz. Bölüm 4.8).
Hastalar endokrinopatilerin klinik belirti ve semptomları, hiperglisemi ve tiroid fonksiyonundaki değişiklikler açısından dikkatli şekilde izlenmelidir (tedavinin başında, tedavi sırasında periyodik olarak ve klinik değerlendirmeye dayanarak gerekli olduğunda). Hastalarda yorgunluk, baş ağrısı, mental durum değişiklikleri, karın ağrısı, olağandışı bağırsak alışkanlıkları ve hipotansiyon veya beyin metastazları ya da altta yatan hastalık gibi diğer nedenlere benzeyen, spesifik olmayan semptomlar görülebilir. Alternatif etiyoloji belirlenene dek, endokrinopati belirti ve semptomlarının immün ilişkili olduğu kabul edilmelidir.
Semptomatik hipotiroidizm için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve gerektiği şekilde tiroid hormon replasmanına başlanmalıdır. Semptomatik hipertiroidizm için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve gerektiği şekilde antitiroid ilaç tedavisine başlanmalıdır. Akut tiroid enflamasyonundan şüpheleniliyorsa, 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben gerekirse nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden
başlatılabilir. Uygun hormon replasmanının kullanıldığından emin olmak için tiroid fonksiyonu sürekli şekilde izlenmelidir.Yaşamı tehdit eden hipertiroidizm veya hipotiroidizm durumunda nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine kalıcı olarak son verilmelidir.
Semptomatik Derece 2 adrenal yetmezlik için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve gerektiği şekilde fizyolojik kortikosteroid replasmanına başlanmalıdır. Ciddi (Derece 3) veya yaşamı tehdit eden (Derece 4) adrenal yetmezlik durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir. Uygun kortikosteroid replasmanının kullanıldığından emin olmak için adrenal fonksiyon ve hormon düzeyleri sürekli şekilde izlenmelidir.
Semptomatik Derece 2 veya 3 hipofizit için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve gerektiği şekilde hormon replasmanına başlanmalıdır. Akut hipofiz bezi enflamasyonundan şüpheleniliyorsa, 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroid tedavisine başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben gerekirse nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden başlatılabilir. Yaşamı tehdit eden (Derece 4) hipofizit durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir. Uygun hormon replasmanının kullanıldığından emin olmak için hipofiz fonksiyonu ve hormon düzeyleri sürekli şekilde izlenmelidir.
Semptomatik diyabet için, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisine ara verilmeli ve gerektiği şekilde insülin replasmanına başlanmalıdır. Uygun insülin replasmanının kullanıldığından emin olmak için kan şekeri sürekli şekilde izlenmelidir. Yaşamı tehdit eden diyabet durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
İmmün ilişkili deri advers reaksiyonları
İpilimumab ile kombinasyon halinde nivolumab tedavisi ile ve daha seyrek olarak nivolumab monoterapisi ile immün ilişkili olabilen şiddetli döküntü gözlenmiştir (bkz. Bölüm 4.8). Derece 3 döküntü görülürse OPDIVO dozuna ara verilmeli, Derece 4 döküntüde nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab kesilmelidir. Şiddetli döküntü için, 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda yüksek doz kortikosteroid tedavisi kullanılmalıdır.
Bazıları fatal sonuç gösteren seyrek SJS ve TEN olguları gözlenmiştir. SJS veya TEN belirti veya bulguları gelişirse, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kesilmelidir ve hasta değerlendirme ve tedavi için uzman bir üniteye yönlendirilmelidir. Hastada nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab kullanımına bağlı SJS veya TEN gelişmişse, nivolumabın kalıcı olarak kesilmesi önerilir. (bkz. Bölüm 4.2)
Diğer immün stimülatör antikanser ilaçları ile önceki tedavi sırasında ciddi veya yaşamı tehdit eden advers cilt reaksiyonları yaşayan bir hastada nivolumab kullanılması düşünülürken dikkatli olunmalıdır.
Diğer immün ilişkili advers reaksiyonlar
Aşağıdaki immün ilişkili advers reaksiyonlar çeşitli dozlarda ve tümör tiplerinde yapılan klinik çalışmalarda nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab ile tedavi edilen hastaların %1'inden azında bildirilmiştir: pankreatit, üveit,
demiyelinasyon, otoimmün nöropati (fasiyal ve abdusens sinir parezisi dahil), Guillain-Barré sendromu, miyastenia gravis, miyastenik sendrom, aseptik menenjit, ensefalit, gastrit, sarkoidoz, duodenit, miyozit, miyokardit ve rabdomiyoliz. Pazarlama sonrasında Vogt- Koyanagi-Harada sendromu, hipoparatiroidizm ve infektif olmayan sistit vakaları bildirilmiştir (bkz. Bölüm 4.2 ve 4.8).
Şüpheli immün ilişkili advers reaksiyonlar için etiyolojiyi doğrulamak veya diğer nedenleri dışlamak için uygun değerlendirmeler yapılmalıdır. Advers reaksiyonun şiddetine dayanarak, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kesilmeli ve kortikosteroidler uygulanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi yeniden başlatılabilir. Herhangi bir şiddetli immün ilişkili advers reaksiyonun tekrarlaması veya yaşamı tehdit eden herhangi bir immün ilişkili reaksiyon görülmesi durumunda nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi kalıcı olarak kesilmelidir.
Nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab ile bazıları ölümcül olan nadir miyotoksisite (miyozit, miyokardit ve rabdomiyoliz) vakaları bildirilmiştir. Bir hastada miyotoksisite belirtileri ve semptomları geliştiği takdirde yakın takip uygulanmalıdır ve hasta gecikmeden değerlendirme ve tedavi uygulanması için bir uzmana sevk edilmelidir. Miyotoksisitenin şiddetine bağlı olarak, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab tedavisi duraklatılmalı veya kesilmelidir (bkz. Bölüm 4.2) ve uygun tedavi başlatılmalıdır.
Miyokardit tanısının konulabilmesi için kuvvetli şüphe gerekir. Kardiyak ya da kardiyopulmoner semptomları olan hastalar miyokardit olasılığı açısından değerlendirilmelidir. Eğer miyokardit şüphesi varsa derhal yüksek doz steroid başlanmalı (prednizon 1 - 2 mg/kg/gün ya da metilprednizolon 1-2 mg/kg/gün) ve derhal kardiyoloji konsültasyonu istenerek güncel klinik rehberlere göre tanısal testlere başlanmalıdır. Miyokardit tanısı konulmasını takiben nivolumab ile tedavi kesilmeli ya da tamamen bırakılmalıdır (bkz. Bölüm 4.2).
Pazarlama sonrası PD-1 inhibitörleriyle tedavi uygulanan hastalarda solid organ nakli reddi bildirilmiştir. Solid organ nakli uygulanan kişilerde nivolumab tedavisi red riskini arttırabilir. Bu hastalarda nivolumabla uygulanan tedavinin olası organ transplantasyonu sonrasında organ reddi riski karşısındaki faydası değerlendirilmelidir.
Monoterapi olarak uygulanan nivolumab ve ipilimumabla kombinasyon halinde kullanılan nivolumabla birlikte hemofagositik lenfohistiyositoz (HLH) gözlenmiştir. Nivolumab monoterapi olarak veya ipilimumabla kombinasyon halinde uygulanırken dikkatli olunmalıdır. HLH doğrulandığı takdirde nivolumab veya ipilimumabla kombinasyon halinde nivolumab uygulaması durdurulmalıdır ve HLH tedavisi başlatılmalıdır.
İnfüzyon reaksiyonları
Nivolumab veya ipilimumab ile kombinasyon halinde nivolumab ile yapılan klinik çalışmalarda ciddi veya yaşamı tehdit eden infüzyon reaksiyonları bildirilmiştir (bkz. Bölüm 4.8). Ciddi ya da yaşamı tehdit edici infüzyon reaksiyonu durumunda, nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab infüzyonu sonlandırılmalı ve uygun tıbbi tedavi uygulanmalıdır. Hafif veya orta şiddetli infüzyon reaksiyonları görülen hastalara nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab yakın gözetim altında ve infüzyon reaksiyonlarının profilaksisine yönelik yerel tedavi kılavuzları uyarınca bir ön ilaç kullanılarak uygulanabilir.
Özel popülasyonlar
Melanom
İlerlemiş melanom
Başlangıç performans skoru ≥ 2 olan, aktif beyin metastazları veya otoimmün hastalık görülen hastalar ve çalışmaya girmeden önce sistemik immünosupresif alan hastalar nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab klinik çalışmalarına alınmamıştır. Oküler/üveal melanomu olan hastalar melanom klinik çalışmasına dahil edilmemiştir. Ayrıca, CA209037 çalışmasına, anti-CTLA-4 tedavisi ile ilişkili Derece 4 advers reaksiyon yaşamış olan hastalar dahil edilmemiştir (bkz. Bölüm 5.1). Yeterli veri bulunmadığından, nivolumab, hastaya özgü dikkatli bir yarar-risk değerlendirmesinin ardından dikkatli şekilde kullanılmalıdır. Başlangıçtaki performans skoru 2 olan, tedavi edilmiş leptomenengeal metastazları olan, oküler/uveal melanomu olan, otoimmün hastalığı olan hastalar ve önceki anti-CTLA-4 tedavisine bağlı olarak Derece 3-4 advers reaksiyon gelişmiş olan hastalar CA209172 çalışmasına alınmıştır (bkz. Bölüm 5.1). Çalışmaya girmeden önce sistemik immünosüpresif tedavi alan hastalar ve aktif beyin ya da leptomenengeal metastazları olan hastalar hakkında veri bulunmaması nedeniyle bu popülasyonda nivolumabın olası yararı/riski bireysel bazda dikkatle değerlendirdikten sonra kullanılması gerekir.
Nivolumab monoterapisine kıyasla, nivolumab ve ipilimumab kombinasyonunda PFS artışı yalnızca düşük tümör PD-L1 ekspresyonuna sahip hastalarda gösterilmiştir. OS'deki iyileşme yüksek tümör PD-L1 ekspresyonuna (PD-L1 ≥ %1) sahip hastalarda ipilimumab ile kombinasyon halinde nivolumab ve nivolumab monoterapisi arasında benzer olmuştur. Kombinasyon tedavisini başlatmadan önce, hekimlere nivolumab monoterapisine kıyasla kombinasyon tedavisinin gözlemlenen yararlarını ve toksisitesini dikkate alarak hastayı ve tümör özelliklerini bireysel olarak dikkatli bir biçimde değerlendirmeleri önerilir (bkz. Bölüm 4.8 ve 5.1).
Hızla ilerleyen hastalığı bulunan melanom hastalarında nivolumab kullanımı
Hızla ilerleyen hastalığı bulunan hastalarda tedaviye başlamadan önce doktorlar nivolumab etkisinin gecikmeli başlangıcını dikkate almalıdır (bkz. bölüm 5.1).
Melanom adjuvan tedavisi
Daha önce otoimmün hastalık ve kortikosteroidlerle (≥ 10 mg günlük prednizon veya eşdeğeri) veya diğer immünosüpresif ilaçlarla sistemik tedavi gerektiren herhangi bir hastalık görülen hastalar ve yanı sıra daha önce melanom için tedavi görmüş olan hastalar (randomizasyondan ≥ 6 ay önce tamamlanmış olması koşuluyla daha önce adjuvan interferon, cerrahi, merkezi sinir sistemi lezyonlarının nörocerrahiyle rezeksiyonu sonrası adjuvan radyoterapi uygulanmış olan hastalar hariç), anti-PD-1, anti-PD-L1, anti-PD-L2, anti-CD137 veya anti-CTLA-4 antikoru (ipilimumab veya spesifik olarak T-hücre kostimulasyonu veya kontrol noktası mekanizmalarını hedef alan başka herhangi bir antikor veya ilaç dahil) ile daha önce tedavi uygulanmış hastalar ve 18 yaşın altındaki gönüllüler adjuvan melanom tedavisine ilişkin pivot çalışmaya dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Veri mevcut olmadığından nivolumab bu popülasyonlarda kişi bazında potansiyel yarar/risk değerlendirmesi yapılmasının ardından dikkatli şekilde kullanılmalıdır.
Hızlı ilerleyen hastalığın görüldüğü melanom hastalarında OPDIVO kullanımı
Doktorlar hastalığın hızlı şekilde ilerlediği hastalarda tedavi başlamadan önce nivolumabın geç etki başlangıcını göz önünde bulundurmalıdır (bkz. Bölüm 5.1).
Küçük Hücreli Dışı Akciğer Kanseri KHDAK'nin birinci basamak tedavisi
Aktif otoimmün hastalığı, semptomatik interstisyel akciğer hastalığı, sistemik
immünosupresyon gerektiren tıbbi koşulları, aktif (tedavi edilmemiş) beyin metastazı olan, ilerlemiş hastalık için daha önce sistemik tedavi görmüş veya EGFR mutasyonları veya ALK translokasyonları olan hastalar, KHDAK'nin birinci basamak tedavisini araştıran kılavuz çalışmalara dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Yaşlı hastalarda (≥ 75 yaş) sınırlı veri mevcuttur (bkz. Bölüm 5.1). Bu hastalarda, ipilimumab ve kemoterapi ile kombinasyon halinde nivolumab, kişi bazında potansiyel yarar/risk değerlendirmesi yapılmasının ardından dikkatli şekilde kullanılmalıdır.
Kemoterapiden sonra KHDAK
Başlangıç performans skoru ≥ 2 olan, aktif beyin metastazları veya otoimmün hastalık görülen, semptomatik interstisyel akciğer hastalığı olan ve çalışmaya girmeden önce sistemik immünosupresan tedaviler alan hastalar KHDAK klinik çalışmalarına alınmamıştır (bkz. Bölüm 4.5 ve 5.1). Başlangıçtaki performans skoru 2 olan hastalar CA209171 çalışmasına alınmıştır (bakınız Bölüm 5.1). Otoimmün hastalığı olan, semptomatik interstisyel akciğer hastalığı olan, aktif beyin metastazları olan hastalar ve çalışmaya girmeden önce sistemik immünosüpresif tedavi alan hastalar, veri bulunmaması nedeniyle bu popülasyonda nivolumabın olası yararı/riski bireysel bazda dikkatle değerlendirdikten sonra kullanılması gerekir.
Doktorlar nispeten kötü prognostik özelliklere ve/veya agresif hastalığa sahip hastalarda tedavi başlatmadan önce nivolumabın geç etki başlangıcını göz önünde bulundurmalıdır. Non-skuamöz KHDAK'de dosetaksele kıyasla nivolumabla 3 ay içinde daha yüksek sayıda ölüm gözlenmiştir. Daha kötü prognostik faktörler ve/veya daha agresif hastalık ile birlikte tümör PD-L1 ekspresyonunun düşük olması veya hiç olmaması erken ölümlerle ilişkili faktörler olmuştur (bkz. Bölüm 5.1).
Malign plevral mezotelyoma
Primitif peritoneal, perikardiyal, testis veya tunika vajinalis mezotelyoması, interstisyel akciğer hastalığı, aktif otoimmün hastalığı, sistemik immünosupresyon gerektiren tıbbi koşulları ve beyin metastazı olan hastalar (cerrahi olarak rezeke edilmedikçe veya stereotaksik radyoterapi ile tedavi edilmedikçe ve tedaviye dahil edilmeden önceki 3 ay içinde herhangi bir gelişme olmadıkça) MPM'nin birinci basamak tedavisini araştıran kılavuz çalışmalara dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Veri bulunmadığından, ipilimumab ile kombinasyon halinde nivolumab bu popülasyonlarda kişi bazında potansiyel yarar/risk değerlendirmesi yapılmasının ardından dikkatli şekilde kullanılmalıdır.
Renal Hücreli Karsinom
Eş zamanlı beyin metastazı varlığı ya da beyin metastazı öyküsü olan, aktif otoimmün hastalığı ya da sistemik immünosupresyon gerektiren tıbbi durumları olan hastalar, pivot RHK çalışmalarına dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Verilerin olmadığı durumlarda nivolumab monoterapisi veya ipilimumab ile kombinasyon halinde nivolumab, bu popülasyonlarda her hasta için bireysel olarak potansiyel risk-yararın dikkatli değerlendirilmesinden sonra dikkatle kullanılmalıdır.
Klasik Hodgkin Lenfoma
Aktif otoimmün hastalığa ve semptomatik interstisyal akciğer hastalığına sahip hastalar,
Klasik Hodgkin lenfoma klinik çalışmalarının dışında bırakılmıştır (bkz. Bölüm 5.1). İlgili
veri mevcut olmadığından OPDIVO bu popülasyonlarda dikkatli bir şekilde, potansiyel fayda/risk oranı bireysel bazda değerlendirildikten sonra kullanılmalıdır.
Klasik Hodgkin Lenfomada allojenik Hematopoietik Kök Hücre Naklinin (HKHN) Komplikasyonları
Nivolumaba maruz kalımın ardından allojenik HKHN uygulanan hastaların izleminden elde edilen ön bulgular, akut greft-versus-host hastalığı (aGVHD) ve transplantla ilişkili mortalite (TRM) vakalarının sayısının beklenenin üzerinde olduğunu göstermiştir. İlave veri elde edilene kadar HKHN'nin potansiyel faydaları ve transplantla ilişkili komplikasyonlarda artış ortaya çıkması potansyeli üzerinde vaka bazında dikkatli bir şekilde durulmalıdır (bkz. Bölüm 4.8).
Allojenik HKHN sonrası nivolumab ile tedavi edilen hastalarda, pazarlama sonrası dönemde bazıları ölümle sonuçlanmış olan hızlı başlangıçlı ve ciddi GVHD bildirilmiştir. Nivolumab ile tedavi, özellikle daha önce GVHD öyküsü olanlar olmak üzere önceden allojenik HKHN geçirmiş olan hastalarda ciddi GVHD ve ölüm riskini artırabilir. Bu hastalarda nivolumab ile tedavinin yararına karşılık muhtemel riskleri göz önünde bulundurulmalıdır (bkz. Bölüm 4.8).
Baş ve Boyun Kanseri
Başlangıç performans skoru ≥2 olan, aktif beyin metastazlarına veya leptomeninjel metastazlara sahip olan, aktif otoimmün hastalık, sistemik immünosupresyon gerektiren tıbbi sorunlar görülen veya primer tümör bölgeleri nazofarenks ya da tükürük bezi karsinomu olan kişiler SHBBK klinik çalışması dışında bırakılmıştır (bkz. Bölüm 4.5 ve 5.1). Veri mevcut olmadığından nivolumab bu popülasyonlarda kişi bazında potansiyel yarar/risk değerlendirmesi yapılmasının ardından dikkatli şekilde kullanılmalıdır.
Doktorlar daha kötü prognostik özelliklere ve/veya agresif hastalığa sahip hastalarda tedaviye başlamadan önce nivolumab etkisinin geç başlangıcını göz önünde bulundurmalıdır. Baş ve boyun kanserinde dosetaksele kıyasla nivolumabla 3 ay içinde daha yüksek sayıda ölüm gözlenmiştir. Erken ölümlerle ilişkili faktörlerin ECOG performans durumu, önceki platin tedavisi sırasında hızlı progresyon sergileyen hastalık ve yüksek tümör yükü olduğu belirlenmiştir.
dMMR veya MSI-H Metastatik Kolorektal Kanser
Bazal performans skoru ≥ 2, aktif beyin metastazları, aktif otoimmün hastalığı veya sistemik immünosüpresyon gerektiren tıbbi rahatsızlıkları olan hastalar, dMMR veya MSI-H mKRK için yapılan klinik çalışmalara dahil edilmemiştir (Bkz. Bölüm 4.5 ve 5.1). Veri bulunmadığı durumlarda, nivolumab bu popülasyonlarda potansiyel yarar/riskin bireysel olarak dikkatli bir şekilde ele alınmasından sonra dikkatli bir şekilde kullanılmalıdır.
Özofagus Skuamöz Hücreli Karsinom
Özofagus skuamöz hücreli karsinomla ilgili mevcut klinik verilerin çoğunluğu Asya kökenli hastalardan elde edilmektedir (bkz. Bölüm 5.1).
Başlangıç performans skoru ≥ 2 olan, semptomatik veya tedavi gerektiren beyin metastazları, yemek borusuna bitişik organlarda (örn. aort veya solunum yolu) belirgin tümör invazyonu, aktif otoimmün hastalığı veya sistemik immünosüpresyon gerektiren tıbbi durumları bulunan hastalar ÖSHK hakkındaki klinik çalışmanın dışında bırakılmıştır (bkz. Bölüm 4.5 ve 5.1). Veri bulunmadığından, nivolumab bu popülasyonlarda kişi bazında potansiyel yarar/risk değerlendirmesi yapılmasının ardından dikkatli şekilde kullanılmalıdır.
Doktorlar ÖSHK'li hastalarda tedaviye başlamadan önce nivolumabın geç etki başlangıcını göz önünde bulundurmalıdır. Kemoterapiye kıyasla, nivolumab ile randomizasyondan sonraki
2,5 ay içinde daha yüksek sayıda ölüm gözlenmiştir. Erken ölümlerle ilgili hiçbir spesifik faktör belirlenememiştir (bkz. Bölüm 5.1).
Bir talidomid analoğu ve deksametazona OPDIVO eklendiğinde multipl miyelom hastalarında artan mortalite
Multipl miyelom hastaları üzerinde gerçekleştirilen randomize klinik çalışmalarda PD-1 veya PD-L1 bloke edici antikorun endike olmadığı bir kullanım olan talidomid analoğu + deksametazona, OPDIVO'nun da aralarında olduğu bir PD-1 bloke edici antikorun eklenmesi mortalitede artışla sonuçlanmıştır. Multipl miyelom hastalarına bir talidomid analoğu + deksametazonla kombinasyon halinde bir PD-1 veya PD-L1 bloke edici antikorla tedavi uygulanması kontrollü klinik çalışmalar dışında önerilmemektedir.
Diğer tüm terapötik proteinlerde olduğu gibi OPDIVO için de potansiyel immunojenesite riski söz konusudur. Biyolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Özofagus veya gastroözofageal bileşke kanserinin adjuvan tedavisi
Başlangıç performans skoru ≥ 2 olup, cerrahi öncesinde eşzamanlı kemoradyoterapi (KRT) almamış, IV. evre rezeke edilebilir hastalığı, aktif otoimmün hastalığı ya da sistemik immünosüpresyon gerektiren tıbbi durumları olan hastalar özofagus ve gastroözofageal bileşke kanseri için yapılan klinik çalışmaya dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Veri bulunmadığında, nivolumab bu popülasyonlarda potansiyel fayda-risk oranının bireysel olarak ele alınmasından sonra dikkatli bir şekilde kullanılmalıdır.
Mide, gastroözofageal bileşke ya da özofagus adenokarsinom
Başlangıç ECOG performans skoru ≥ 2 olup, tedavi edilmemiş merkezi sinir sistemi metastazları olan, aktif, bilinen ya da şüphelenilen otoimmün hastalığı bulunan veya sistemik immünosüpresyon gerektiren tıbbi durumları mevcut hastalar, mide, GBK ya da özofagus adenokarsinomu için yapılan klinik çalışmaya dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Veri bulunmadığında, kemoterapi ile kombinasyon halindeki nivolumab bu popülasyonlarda potansiyel fayda-risk oranının bireysel olarak ele alınmasından sonra dikkatli bir şekilde kullanılmalıdır.
Çalışma CA209649'da, bilinen HER-2 pozitif durumu olan hastalar hariç tutulmuştur. Belirsiz durumdaki hastaların çalışmaya katılmasına izin verilmiş olup; hastaların %40,3'ünü temsil ediyorlardı (bkz. Bölüm 5.1).
Kontrollü sodyum diyetindeki hastalar
Her 1 mL müstahzar 0,1 mmol (veya 2,5 mg) sodyum içerir. Kontrollü sodyum diyetinde olan hastaları tedavi ederken bu durum dikkate alınmalıdır.
Hasta Uyarı Kartı
OPDIVO reçeteleyen tüm uzmanlar Doktorlara Yönelik Bilgi ve Yönetim Kılavuzları konusunda bilgi sahibi olmalıdır. Reçeteyi yazan uzman OPDIVO tedavisinin riskleri konusunda hasta ile konuşmalıdır. Hastaya her reçete ile birlikte Hasta Uyarı Kartı verilecektir.
İzlenebilirlik
Biyolojik tıbbi ürünlerin izlenebilirliğini arttırmak için uygulanan ürünün adı ve seri numarası açık şekilde kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Nivolumab insana özgü bir monoklonal antikor olduğundan, farmakokinetik etkileşim çalışmaları gerçekleştirilmemiştir. Monoklonal antikorlar sitokrom P450 (CYP) enzimleri veya diğer ilaç metabolize eden enzimler tarafından metabolize edilmediğinden, eşzamanlı uygulanan ilaçlarla bu enzimlerin inhibisyonu veya indüksiyonunun nivolumabın farmakokinetiğini etkilemesi beklenmez.
Diğer etkileşim formları
Sistemik immünosüpresyon
Farmakodinamik aktiviteyle etkileşim potansiyeli nedeniyle nivolumaba başlamadan önce, başlangıçta sistemik kortikosteroidlerin ve diğer immünosupresanların kullanımından kaçınılmalıdır. Yine de, immün ilişkili advers reaksiyonların tedavi edilmesi için nivolumaba başlandıktan sonra sistemik kortikosteroidler veya diğer immünosüpresanlar kullanılabilir. Başlangıçta alınan sonuçlar, OPDIVO tedavisine başlandıktan sonra sistemik immünosüpresyon kullanımının, nivolumaba verilen yanıtı bozmadığını göstermektedir.
Özel popülasyonlara ilişkin ek bilgiler
Hiçbir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
Hiçbir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Genel tavsiyeGebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar /Doğum kontrolü (kontrasepsiyon)
Klinik yararları olası risklerinden fazla olmadıkça etkili bir doğum kontrol yöntemi kullanmayan çocuk doğurma potansiyeline sahip kadınlarda nivolumab kullanımı önerilmemektedir. Kadınlara nivolumabın son dozunu takip eden en az 5 ay süresince etkili bir doğum kontrol yöntemi kullanmaları önerilmelidir.
Gebelik dönemi
Gebe kadınlarda nivolumab kullanımına ilişkin herhangi bir veri mevcut değildir. Hayvanlarda yapılan çalışmalar embriyofetal toksisite kanıtı göstermiştir (bkz. Bölüm 5.3). İnsan IgG4'ünün plasenta bariyerini geçtiği bilinmektedir ve nivolumab bir IgG4 olduğundan; nivolumabın anneden gelişmekte olan fetusa taşınma potansiyeli vardır. Nivolumab, klinik yararları olası risklerinden fazla olmadıkça, gebelik sırasında kullanılmamalıdır.
Laktasyon dönemi
Nivolumabın anne sütüne geçip geçmediği bilinmemektedir. Antikorlar dahil olmak üzere birçok tıbbi ürün anne sütüne geçtiğinden, yeni doğanda/bebekte oluşabilecek risk göz ardı edilemez. Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak, emzirmenin veya nivolumab tedavisinin kesilmesi konusunda bir karar verilmelidir.
Üreme yeteneği/Fertilite
Nivolumabın fertilite üzerindeki etkilerini değerlendiren çalışmalar yapılmamıştır. Bu durumda, nivolumabın erkek ve dişi fertilitesi üzerindeki etkisi bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
5.1. Farmakodinamik özellikler
ine dayanarak, nivolumabın araç ve makine kullanma becerisini etkilemesi beklenmez. Yorgunluk gibi potansiyel advers reaksiyonlara yol açabilmesi nedeniyle (bkz. Bölüm 4.8), hastalara OPDIVO'nun kendilerini ters bir şekilde etkilemediğinden emin olana dek araç veya makine kullanmaları konusunda dikkatli olmaları önerilmelidir.
4.8. İstenmeyen etkiler
Monoterapi olarak nivolumab (bkz. Bölüm 4.2)
Güvenlilik profilinin özeti
Çeşitli tümör tiplerinde nivolumab monoterapisi ile yapılan çalışmaların (n = 4122) birleştirilmiş veri setinde minimum takip aralığı 2,3 ila 28 ay olup, en yaygın (≥ %10) yan etkiler yorgunluk (%45), kas iskelet ağrısı (%31), diyare (%26), bulantı (%23), öksürük
(%24), döküntü (%24), dispne (%17), kaşıntı (%19), iştahsızlık (%18), kabızlık (%17), karın
ağrısı (%16), üst solunum yolu enfeksiyonu (%16), artralji (%14), pireksi (%14), kusma (%14), baş ağrısı (%13) ve ödem (%10) olmuştur. . Advers reaksiyonların çoğu hafif ila orta şiddetliydi (Derece 1 veya 2). KHDAK'de minimum 63 aylık bir izlemle herhangi yeni bir güvenlilik sinyali tespit edilmemiştir.
Yan etkilerin özeti
Nivolumab monoterapisi ile tedavi edilen hastalar için (n = 4122) birleştirilmiş veri setinde bildirilen advers reaksiyonlar Tablo 4'te listelenmiştir. Bu reaksiyonlar, sistem organ sınıfı ve sıklık kategorilerine göre sunulmuştur. Sıklık terimleri aşağıdaki şekilde tanımlanmaktadır: çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık derecesi grubunda advers reaksiyonlar azalan ciddiyet sırasında göre sunulmaktadır.
Tablo 4: Nivolumab monoterapisi ile gözlenen advers reaksiyonlar
Enfeksiyonlar ve enfestasyonlar | |
Çok yaygın: | Üst solunum yolu enfeksiyonu |
Yaygın: | Pnömoni, bronşit |
Seyrek | Aseptik menenjit |
(Kist ve polipler de dahil olmak üzere) iyi huylu, kötü huylu ve belirlenemeyen neoplazma | |
Seyrek: | Histositik nekrotizan lenfadenit (Kikuchi lenfadenit) |
Kan ve lenf sistemi hastalıkları | |
Çok Yaygın: | Lenfopeni , anemi, lökopeni, nötropeni, trombositopeni |
Yaygın olmayan | Eozinofili |
Bilinmiyor: | Hemofagositik lenfohistiyositoz |
Bağışıklık sistemi hastalıkları | |
Yaygın: | İnfüzyonla ilişkili reaksiyon, aşırı duyarlılık (anafilaktik reaksiyonu içeren) |
Yaygın olmayan: | Sarkoidozis |
Bilinmiyor: | Solid organ nakli reddi |
Endokrin hastalıkları | |
Yaygın: | Hipotiroidizm, hipertiroidizm, tiroidit |
Yaygın olmayan: | Adrenal yetmezlik, hipopituitarizm, hipofizit, diyabet mellitus |
Seyrek | Diyabetik ketoasidoz, hipoparatiroidi |
Metabolizma ve beslenme hastalıkları | |
Çok yaygın: | İştah azalması, hiperglisemi, hipoglisemi |
Yaygın: | Dehidratasyon, kilo kaybı |
Yaygın olmayan: | Metabolik asidoz |
Bilinmiyor: | Tümör lizis sendromu |
Sinir sistemi hastalıkları | |
Çok yaygın: | Baş ağrısı |
Yaygın: | Periferik nöropati, sersemlik |
Yaygın olmayan: | Polinöropati, otoimmün nöropati (fasiyal ve oküler sinir parezisi dahil) |
Seyrek: | Guillain-Barré sendromu, demiyelinizasyon, miyastenik sendrom, ensefalit |
Göz hastalıkları | |
Yaygın: | Bulanık görme, göz kuruluğu |
Yaygın olmayan: | Üveit |
Bilinmiyor: | Vogt-Koyanagi-Harada sendromu |
Kardiyak hastalıklar | |
Yaygın: | Taşikardi, atriyal fibrilasyon |
Yaygın olmayan: | Miyokardit, perikardiyal bozukluklar, aritmi (ventriküler aritmi dahil) |
Vasküler hastalıklar | |
Yaygın: | Hipertansiyon |
Seyrek: | Vaskülit |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | |
Çok yaygın: | Dispne, öksürük |
Yaygın: | Pnömoni, plevral efüzyon |
Yaygın olmayan | Akciğer infiltrasyonu |
Gastrointestinal hastalıklar | |
Çok yaygın: | Diyare, kusma, bulantı, karın ağrısı, kabızlık |
Yaygın: | Kolit, stomatit, ağız kuruluğu |
Yaygın olmayan: | Pankreatit, gastrit |
Seyrek: | Duodenal ülser |
Hepatobiliyer hastalıklar | |
Yaygın olmayan: | Hepatit, kolestazis |
Deri ve deri altı doku hastalıkları | |
Çok yaygın: | Döküntü, kaşıntı |
Yaygın: | Vitiligo, kuru cilt, eritem, alopesi, ürtiker |
Yaygın olmayan: | Eritema multiforme, psoriasis, rosacea |
Seyrek: | Toksik epidermal nekroliz , Stevens-Johnson sendromu |
Bilinmiyor: | Liken sklerozus, diğer liken bozuklukları |
Kas iskelet bozuklukları ve bağ doku hastalıkları | |
Çok yaygın: | Kas iskelet ağrısı, artralji |
Yaygın: | Artrit |
Yaygın olmayan: | Polimyalji romatika |
Seyrek: | Sjogren's sendrom, miyopati, miyozit (polimiyozit dahil), rabdomiyoliz, |
Böbrek ve idrar yolu hastalıkları | |
Yaygın: | Böbrek yetmezliği (akut böbrek hasarı dahil) |
Seyrek: | Tubulointerstisyel nefrit, infektif olmayan sistit |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |
Çok yaygın: | Yorgunluk, pireksi, ödem |
Yaygın | Ağrı, göğüs ağrısı |
Araştırmalar | |
Çok yaygın: | AST artışı, hiponatermi, hipoalbuminemi, alkalen fosfataz artışı, kreatinin artışı, ALT artışı, lipaz artışı, hiperkalemi, amilaz artışı, hipokalsemi, hipomagnezemi, hipokalemi, hiperkalsemi |
Yaygın: | Toplam bilirubin artışı, hipernatremi, hipermagnezemi |
Tablo 4'te sunulan advers reaksiyon sıklıkları, tam olarak tek başına nivolumaba bağlanamaz, ancak altta yatan hastalığa katkıda bulunabilir.
Tamamlanmış veya devam eden klinik çalışmalarda fatal olgular bildirilmiştir.
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda doz aşımı vakası bildirilmemiştir. Doz aşımı halinde, hastanın advers reaksiyon bulgu ve semptomları açısından yakından gözlemlenmesi ve uygun semptomatik tedaviye başlanması önerilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
ine dayanarak, nivolumabın araç ve makine kullanma becerisini etkilemesi beklenmez. Yorgunluk gibi potansiyel advers reaksiyonlara yol açabilmesi nedeniyle (bkz. Bölüm 4.8), hastalara OPDIVO'nun kendilerini ters bir şekilde etkilemediğinden emin olana dek araç veya makine kullanmaları konusunda dikkatli olmaları önerilmelidir.
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar,antikor ilaç ATC kodu: L01FF01.
Etki mekanizması
Nivolumab, programlanmış ölüm-1 (PD-1) reseptörüne bağlanan ve PD-L1 ve PD-L2 ile etkileşimi bloke eden insan immünoglobulin G4 (IgG4) monoklonal antikorudur (HuMAb).
PD-1 reseptörü, T-hücre immün yanıtlarının kontrolüne katıldığı gösterilmiş olan, T-hücre aktivitesinin negatif bir düzenleyicisidir. PD-1'in, antijen sunucu hücreler tarafından ve belki de tümör veya tümör mikroçevresindeki diğer hücreler tarafından da eksprese edilebilen PD-L1 ve PD-L2 ligandlarıyla bağlanması, T-hücre proliferasyonunun ve sitokin salımının
inhibisyonu ile sonuçlanır. Nivolumab, PD-1'in PD-L1 ve PD-L2 ligandlarına bağlanmasını bloke ederek, anti-tümör yanıtlar dahil, T-hücresi yanıtlarını arttırır. Genetik olarak özdeş fare modellerinde, bloke edici PD-1 aktivitesi, tümör büyümesinin azalması ile sonuçlanmıştır.
Klinik etkililik ve güvenlilik
Doz/maruziyet etkililik ve güvenlilik ilişkilerinin modellenmesine dayanarak, her 2 haftada bir 240 mg veya her 2 haftada bir 3 mg/kg nivolumab arasında etkililik ve güvenlilik açısından klinik olarak anlamlı bir fark bulunmamaktadır. Ek olarak, bu ilişkilere dayanarak, RHK'de 4 haftada bir 480 mg veya her 2 haftada bir 3 mg/kg nivolumab dozu arasında klinik olarak anlamlı bir fark görülmemiştir.
Melanom
İlerlemiş melanom tedavisi
Dakarbazin karşısında randomize faz 3 çalışma (CA209066)
Nivolumab 3 mg/kg'ın ilerlemiş (rezeke edilemeyen veya metastatik) melanom tedavisi için güvenliliği ve etkililiği bir faz 3, randomize, çift kör çalışmada (CA209066) değerlendirilmiştir. Çalışmaya doğrulanmış, tedavi uygulanmamış, Evre III veya IV BRAF vahşi tip melanomu olan ve ECOG performans durumu 0 veya 1 olan yetişkin hastalar (18 yaş ve üzeri) dahil edilmiştir. Aktif otoimmün hastalığı, oküler melanomu veya aktif beyin ya da leptomeningeal metastazları bulunan hastalar çalışmaya alınmamıştır.
Toplam 418 hasta her 2 haftada bir 60 dakika süreyle intravenöz yoldan uygulanan 3 mg/kg dozunda nivolumab (n = 210) veya her 3 haftada bir 1000 mg/m2 dozunda dakarbazin (n = 208) almak üzere randomize edilmiştir. Randomizasyon, tümör PD-L1 durumu ve M evresi (M1c karşısında M0/M1a/M1b) ile basamaklandırılmıştır. Tedavi, klinik yarar gözlendiği sürece veya tedavi hasta tarafından artık tolere edilemeyinceye kadar sürdürülmüştür. Hastalık progresyonundan sonra tedaviye, araştırmacı tarafından belirlendiği gibi klinik yarar gören ve çalışma ilacı ile önemli bir advers olay yaşamamış olan hastalarda izin verilmiştir. Tümör değerlendirmeleri, randomizasyondan 9 hafta sonra, ardından ilk yıl her 6 haftada bir ve bunu takip eden yıllarda her 12 haftada bir, Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST), versiyon 1.1 uyarınca gerçekleştirilmiştir. Primer etkililik sonlanım noktası genel sağkalımdı (OS). Kilit sekonder etkililik sonlanım noktası ölçümleri, araştırmacı tarafından değerlendirilen progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) idi.
İki grup arasında başlangıç özellikleri dengelenmişti. Yaş ortalaması 65 olup (aralık: 18 - 87)
%59'u erkek ve %99,5'i beyazdı. Başlangıç ECOG performans durumu puanı 0 (%64) veya 1 (%34) idi. Hastaların %61'i, çalışmaya girişte evre M1c hastalığa sahipti. %74'ü kutanöz melanom, %11'i mukozal melanom; %35'i ise PD-L1 pozitif melanoma sahipti (>%5 tümör hücresi membran ekspresyonu). Hastaların %16'sı, daha önce adjuvan tedavi görmüş olup en yaygın kullanılan adjuvan tedavi interferondu (%9). Hastaların %4'ünde çalışma girişinde beyin metastazı, %37'sinde ise ULN'den yüksek LDH düzeyi mevcuttu.
OS için Kaplan-Meier eğrileri Şekil 1'de gösterilmektedir.
Progresyonsuz sağkalım
Şekil 1. Kaplan-Meier OS eğrileri (CA209066)
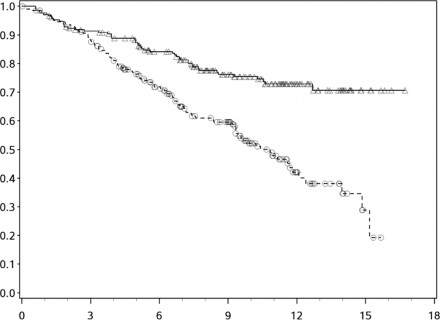
Genel Sağkalım (Ay)
Riskli gönüllülerin sayısı | ||||||
Nivolumab | ||||||
210 | 185 | 150 | 105 | 45 | 8 | 0 |
Dakarbazin | ||||||
208 | 177 | 123 | 82 | 22 | 3 | 0 |
âââââ Nivolumab (olaylar: 50/210), medyan ve %95 GA: geçerli değil.
- - -ï¦- - - Dakarbazin (olaylar: 96/208), medyan ve %95 GA: 10,84 (9,33 - 12,09)
Gözlenen OS yararı, başlangıç ECOG performans durumu, M evresi, beyin metastaz öyküsü ve başlangıç LDH düzeyi dahil hasta alt gruplarında tutarlı şekilde gösterilmiştir.
Tümörlerin PD-L1 negatif veya PD-L1 pozitif olarak sınıflandırılmasından bağımsız olarak sağkalım yararı gözlenmiştir (%5 veya %10'luk tümör membranı ekspresyonu eşik değeri).
Elde edilen veriler, nivolumabın geç etki başlangıcına sahip olduğunu ve kemoterapiden sonra nivolumab yararının ortaya çıkmasının 2-3 ay sürebileceğini göstermiştir.
Yanıt oranları, yanıta kadar geçen süre ve yanıt süreleri Tablo 9'da gösterilmektedir.
Tablo 9: Etkililik Sonuçları (CA209066)
| nivolumab (n = 210) | dakarbazin (n = 208) |
Genel sağkalım |
| |
Olaylar | 50 (%23,8) | 96 (%46,2) |
Risk oranı | 0,42 | |
%99,79 GA | (0,25 - 0,73) | |
%95 GA | (0,3 - 0,6) | |
p-değeri | < 0,0001 | |
Medyan (%95 GA) | Erişilmedi | 10,8 (9,33 - 12,09) |
Oran (%95 GA) |
| |
6. ayda | 84,1 (78,3 - 88,5) | 71,8 (64,9 - 77,6) |
12. ayda | 72,9 (65,5 - 78,9) | 42,1 (33 - 50,9) |
Progresyonsuz sağkalım |
| |
Olaylar | 108 (%51,4) | 163 (%78,4) |
Risk oranı | 0,43 | |
%95 GA | (0,34 - 0,56) | |
p-değeri | < 0,0001 | |
Medyan (%95 GA) | 5,1 (3,48 - 10,81) | 22 (2,1 - 2,4) |
Oran (%95 GA) |
| |
6. ayda | 48 (40,8 - 54,9) | 18,5 (13,1 - 24,6) |
12. ayda | 41,8 (34 - 49,3) | NA |
Objektif yanıt | 84 (%40) | 29 (%13,9) |
(%95 GA) | (33,3 - 47) | (9,5 - 19,4) |
Olasılık oranı (%95 GA) | 4,06 (2,52 - 6,54) |
|
p-değeri | < 0,0001 |
|
Tam yanıt (CR) | 16 (%7,6) | 2 (%1) |
Kısmi yanıt (PR) | 68 (%32,4) | 27 (%13) |
Stabil hastalık (SD) | 35 (%16,7) | 46 (%22,1) |
Medyan yanıt süresi |
| |
Ay (aralık) | Erişilmedi (0 - 12,5) | 6 (1,1 - 10) |
Yanıta kadar medyan süre |
| |
Ay (aralık) | 2,1 (1,2 - 7,6) | 2,1 (1,8 - 3,6) |
ââ gizlenen bir gözlemi gösterir.
Kemoterapi karşısında randomize faz 3 çalışma (CA209037)
Nivolumab 3 mg/kg'ın ilerlemiş (rezeke edilemeyen veya metastatik) melanom tedavisi için güvenliliği ve etkililiği bir faz 3, randomize, açık etiketli çalışmada (CA209037) değerlendirilmiştir. Çalışma ipilimumab tedavisi sırasında veya sonrasında progresyon görülen ve (BRAF V600 mutasyonu pozitif ise) BRAF kinaz inhibitörü tedavisi sırasında veya sonrasında progresyon görülen hastaları içermiştir.
Aktif otoimmün hastalığı ve oküler melanomu, aktif beyin veya leptomeningeal metastazları olanlar veya iyileşmiş bulantı, yorgunluk, infüzyon reaksiyonları veya endokrinopatiler hariç önceden ipilimumab ile ilişkili yüksek dereceli (CTCAE v4.0 uyarınca Derece 4) advers reaksiyon yaşayan hastalar çalışmaya dahil edilmemiştir.
Toplam 405 hasta her 2 haftada bir 60 dakika süreyle intravenöz yoldan uygulanan 3 mg/kg dozunda nivolumab (n = 272) veya araştırmacının kararına göre dakarbazin (her 3 haftada bir 1000 mg/m2) veya karboplatin (her 3 haftada EAA 6) ve paklitaksel (her 3 haftada bir
175 mg/m2) içeren kemoterapi (n = 133) almak üzere randomize edilmiştir. Randomizasyon, BRAF ve tümör PD L1 durumu ve önceki ipilimumab tedavisine verilen en iyi yanıta göre basamaklandırılmıştır.
Yardımcı primer etkililik sonuç ölçümleri, nivolumab tedavisi gören ilk 120 gönüllüde RECIST versiyon 1.1 kullanılarak bağımsız bir radyolojik inceleme komitesi (IRRC) tarafından ölçüldüğü gibi doğrulanmış ORR ve nivolumab ile elde edilen OS'nin kemoterapi ile karşılaştırılmasını içermiştir. İlave sonuç ölçümleri, yanıt süresi ve zamanıydı.
Hastaların medyan yaşı 60 idi (aralık: 23 - 88). Hastaların yüzde %64'ü erkekti ve %98'i beyazdı. ECOG performans skorları hastaların %61'i için 0 ve %39'u için 1 idi. Hastaların çoğunluğu (%75) çalışmaya girişte evre M1c hastalığa sahipti. Hastaların %73'ü kutanöz melanom ve %10'u mukozal melanom idi.
Önceden alınan sistemik tedavi sayısı hastaların %27'sinde 1, %51'inde 2 ve %21'inde
> 2 idi. Hastaların %22'sinin BRAF mutasyonu pozitifti ve %50'si PD-L1 pozitifti. Hastaların
%64'ü, önceki ipilimumab tedavisinden klinik yarar (CR/PR ya da SD) görmemiştir.
Başlangıç özellikleri, beyin metastazı olan hastaların oranı (nivolumab grubu ve kemoterapi grubunda sırasıyla %19 ve %13) ve başlangıç LDH düzeyi ULN'den yüksek olan hastaların oranı (sırasıyla %51 ve %35) hariç, gruplar arasında dengeliydi.
Bu nihai ORR analizi döneminde, en az 6 ay takip edilen nivolumab alan 120 hastadan ve kemoterapi alan 47 hastadan alınan sonuçlar analiz edilmiştir. Etkililik sonuçları Tablo 10'da sunulmuştur.
Tablo 10: En iyi genel yanıt, zaman ve yanıt süresi (CA209037)
| nivolumab (n = 120) | kemoterapi (n = 47) |
Objektif yanıt (IRRC) |
38 (%31,7) |
5 (%10,6) |
(%95 GA) | (23,5 - 40,8) | (3,5 - 23,1) |
Tam yanıt (CR) | 4 (%3,3) | 0 |
Kısmi yanıt (PR) | 34 (%28,3) | 5 (%10,6) |
Stabil hastalık (SD) | 28 (%23,3) | 16 (%34) |
Medyan Yanıt Süresi |
| |
Ay (aralık) | Erişilmedi | 3,6 (Mevcut değildir) |
Yanıta kadar medyan süre |
| |
Ay (aralık) | 2,1 (1,6 - 7,4) | 3,5 (2,1 - 6,1) |
Elde edilen veriler, nivolumabın geç etki başlangıcına sahip olduğunu ve kemoterapiden sonra nivolumab yararının ortaya çıkmasının 2-3 ay sürebileceğini göstermiştir.
Güncellenmiş analiz (24 aylık izlem)
Randomize edilmiş tüm hastalarda ORR nivolumab grubunda %27,2 (%95 GA: 22 â 32,9),
kemoterapi grubunda ise %9,8 (%95 GA: 5,3 â 16,1) olarak belirlenmiştir. Medyan yanıt
süresinin sırasıyla 31,9 ay (aralık: 1,4+ - 31,9) ve 12,8 ay (aralık: 1,3+ - 13,6+) olduğu tespit edilmiştir. Nivolumab â kemoterapi karşılaştırmasına ilişkin PFS HR değerinin 1,03 (%95
GA: 0,78 â 1,36) olduğu belirlenmiştir. ORR ve PFS, IRRC tarafından RECIST versiyon 1.1 ile değerlendirilmiştir.
Nihai OS analizinde nivolumab ile kemoterapi arasında istatistiksel açıdan anlamlı fark gözlenmemiştir. Primer OS analizi, takip eden tedaviler hesaba katılacak şekilde ayarlanmamıştır ve kemoterapi kolundaki hastaların 54'ü (%40,6) bir anti-PD1 tedavisi görmüştür. Tedaviyi bırakanlar, sonraki tedavilerin dengesizliği ve başlangıç faktörlerindeki farklılıklar OS'de karışıklığa neden olmuş olabilir. Kemoterapi kolundakilere kıyasla nivolumab kolunda bulunan daha fazla hastanın kötü prognostik faktörlere (yüksek LDH ve beyin metastazları) sahip olduğu belirlenmiştir.
BRAF durumuna göre etkililik:
BRAF mutasyonu-pozitif melanom görülen ve görülmeyen hastalarda nivolumaba objektif yanıtlar (eş primer sonlanım noktası tanımlamasına göre) gözlenmiştir. ORR'ler BRAF mutasyonu-pozitif alt grupta nivolumab için %17 (%95 GA: 8,4 â 29) kemoterapi için %11
(%95 GA: 2,4 â 29,2), BRAF yabanıl tip alt grupta ise sırasıyla %30 (%95 GA: 24 â 36,7) ve
%9 (%95 GA: 4,6 â 16,7) olarak belirlenmiştir.
Nivolumab-kemoterapi karşılaştırmasına ilişkin PFS HR değerleri BRAF mutasyonu-pozitif hastalar için 1,58 (%95 GA: 0,87 â 2,87), BRAF yabanıl tip hastalar içinse 0,82 (%95 GA: 0,6 â 1,12) olarak belirlenmiştir. Nivolumab-kemoterapi karşılaştırmasına ilişkin OS HR değerleri BRAF mutasyonu-pozitif hastalar için 1,32 (%95 GA: 0,75 â 2,32), BRAF yabanıl
tip hastalar içinse 0,83 (%95 GA: 0,62 â 1,11) olarak belirlenmiştir.
Tümör PD-L1 ekspresyonuna göre etkililik:
Tümör PD-L1 ekspresyonundan bağımsız şekilde nivolumaba objektif yanıtlar gözlenmiştir. Bununla birlikte, bu biyobelirtecin (tümör PD-L1 ekspresyonu) rolü tam olarak açıklığa kavuşturulmamıştır.
Tümör PD-L1 ekspresyonu ≥%1 olan hastalarda ORR nivolumab için %33,5 (n=179; %95 GA: 26,7 - 40,9) kemoterapi içinse %13,5 (n=74; %95 GA: 6,7 - 23,5) olarak belirlenmiştir. Tümör PD-L1 ekspresyonu <%1 olan hastalarda IRRC'ye göre ORR sırasıyla %13 (n=69;
%95 GA: 6,1 â 23,3) ve %12 (n=25; %95 GA: 2,5 â 31,2) olarak belirlenmiştir.
Nivolumab-kemoterapi karşılaştırmasına ilişkin PFS HR değerleri tümör PD-L1 ekspresyonu
≥%1 olan hastalarda 0,76 (%95 GA: 0,54 â 1,07), tümör PD-L1 ekspresyonu <%1 olan
hastalarda ise 1,92 (%95 GA: 1,05 â 3,5) olarak belirlenmiştir.
Nivolumab-kemoterapi karşılaştırmasına ilişkin OS HR değerleri tümör PD-L1 ekspresyonu
≥%1 olan hastalarda 0,69 (%95 GA: 0,49 â 0,96), tümör PD-L1 ekspresyonu <%1 olan
hastalarda ise 1,52 (%95 GA: 0,89 â 2,57) olarak belirlenmiştir.
Alt grupların küçük boyutu ve randomize edilmiş olan tüm popülasyonda OS'de istatistiksel açıdan anlamlı fark bulunmadığı göz önünde bulundurulduğunda, bu alt grup analizleri dikkatli şekilde yorumlanmalıdır.
Açık etiketli faz 1 doz yükseltme çalışması (MDX1106-03)
Nivolumabın güvenliliği ve etkililiği, malign melanom dahil çeşitli tümör tiplerinde yapılan bir faz 1, açık etiketli, doz yükseltme çalışmasında değerlendirilmiştir. Çalışmaya alınan daha önceden tedavi görmüş 306 hastanın 107'si melanom idi ve en fazla 2 yıl süreyle 0,1 mg/kg, 0,3 mg/kg, 1 mg/kg, 3 mg/kg veya 10 mg/kg dozunda nivolumab almışlardır. Bu hasta popülasyonunda, medyan 22,9 aylık yanıt süresi ile (%95 GA:17, NR) %9 (%95 GA: 2,6 -
22,1) 33 hastada (%31) objektif yanıt bildirilmiştir. Medyan PFS süresi 3,7 aydı (%95 GA:
1,9 - 9,3). Medyan OS 17,3 ay (%95 GA: 12,5 â 37,8), tahmini OS oranları ise 3 yılda %42
(%95 GA: 32 - 51), 4 yılda %35 (%95 GA: 26 - 44), 5 yılda ise %34 (%95 GA: 25 - 43) olarak
hesaplanmıştır (minimum izlem 45 ay).
İpilimumab monoterapisine karşı ipilimumabla kombinasyon halinde nivolumab ya da monoterapi olarak nivolumab ile randomize faz 3 çalışma (CA209067)
İpilimumab 3 mg/kg monoterapisine karşı ipilimumab ile kombinasyon halinde nivolumab 1 mg/kg veya nivolumab 3 mg/kg monoterapisinin ileri evre (rezeke edilemeyen ya da metastatik) melanom tedavisindeki güvenliliği ve etkililiği faz 3, randomize, çift-kör bir çalışmada değerlendirilmiştir (CA209067). Nivolumab içeren iki grup arasındaki farklar tanımlayıcı bir biçimde değerlendirilmiştir. Çalışma, rezeke edilemeyen doğrulanmış Evre III veya Evre IV melanomu olan yetişkin hastaları içermiştir. Hastaların ECOG performans durumu puanının 0 veya 1 olması gerekmiştir. Rezeke edilemeyen veya metastatik melanom için daha önce sistemik kanser tedavisi görmemiş olan hastalar çalışmaya kaydedilmiştir. Randomizasyondan en az 6 hafta önce tamamlandıysa, önceki adjuvan veya neoadjuvan tedaviye izin verilmiştir. Aktif otoimmün hastalığı, oküler/üveal melanom veya aktif beyin veya leptomeningeal metastazı olan hastalar çalışmaya dahil edilmemiştir.
Toplam 945 hasta; ipilimumab ile kombinasyon halinde nivolumab (n=314), nivolumab monoterapisi (n=316) ya da ipilimumab monoterapisi (n=315) almak üzere randomize edilmiştir. Kombinasyon kolundaki hastalara ilk 4 doz boyunca her 3 haftada bir 60 dakika süreyle nivolumab 1 mg/kg ve 90 dakika süreyle ipilimumab 3 mg/kg uygulanmış, bunu takiben her iki haftada bir monoterapi olarak nivolumab 3 mg/kg verilmiştir. Nivolumab monoterapi kolundaki hastalara her 2 haftada bir nivolumab 3 mg/kg uygulanmıştır. Karşılaştırma kolundaki hastalara 4 doz boyunca her 3 haftada bir intravenöz yoldan ipilimumab 3 mg/kg ve nivolumabla eşleştirilmiş plasebo uygulanmış, bunu her 2 haftada bir plasebo takip etmiştir. Randomizasyon PD-L1 ekspresyonu (≥% 5'e karşılık <% 5 tümör hücre membranı ekspresyonu), BRAF durumu ve Amerikan Ortak Kanser Komitesi (AJCC) evreleme sistemine göre aşama M'ye göre basamaklandırılmıştır. Tedaviye klinik yarar gözlenene veya tedavi artık tolere edilemeyene kadar devam edilmiştir. Tümör değerlendirmeleri randomizasyondan 12 hafta sonra, ardından ilk yıl için her 6 haftada bir ve daha sonra her 12 haftada bir yapılmıştır. Yardımcı primer sonuç ölçümleri progresyonsuz sağkalım ve OS idi. ORR ve yanıt süresi de değerlendirilmiştir.
Başlangıç özellikleri üç tedavi grubu arasında dengelenmiştir. Medyan yaş 61 yıl olup (aralık: 18 - 90), hastaların %65'i erkek ve %97'si beyazdı. ECOG performans durumu puanı 0 (%73) veya 1'di (%27). Hastaların çoğunda AJCC Evre IV hastalık (%93); çalışmaya girişte
%58'inde M1c hastalık mevcuttu. Hastaların %22'si daha once adjuvan tedavi almıştı. Hastaların %32'sinde BRAF mutasyonu pozitif melanom; %26,5'inde PD-L1 ≥ %5 tümör hücre membranı ekspresyonu mevcuttu. Hastaların %4'ü beyin metastazı öyküsüne ve hastaların %36'sı çalışmaya girişte ULN'den daha yüksek bir başlangıç LDH seviyesine sahipti. Ölçülebilir tümör PD-L1 ekspresyonu olan hastalar arasında, hastaların dağılımı üç tedavi grubunda dengelenmiştir. Tümör PD-L1 ekspresyonu, PD-L1 IHC 28-8 pharmDx tayini kullanılarak belirlenmiştir.
Primer analizde (minimum takip 9 ay), nivolumab grubunda medyan PFS 6,9 ay iken ipilimumab grubunda 2,9 aydı (HR = 0,57, %99,5 GA: 0,43, 0,76; p< 0,0001). İpilimumabla kombinasyon halindeki nivolumab grubunda medyan PFS 11,5 ay ile ipilimumab grubunda 2,9 aydı (HR = 0,42, %99,5 GA: 0,31, 0,57; p < 0,0001)
PFS sonuçları (minimum 90 aylık takip süresi ile) olarak Şekil 2'de (randomize edilmiş tüm popülasyon), Şekil 3'te (tümör PD-L1 %5 eşik değerinde) ve Şekil 4'te (tümör PD-L1 %1 eşik değerinde) gösterilmektedir.
Progresyonsuz sağkalım olasılığı
Şekil 2: Progresyonsuz sağkalım (CA209067)
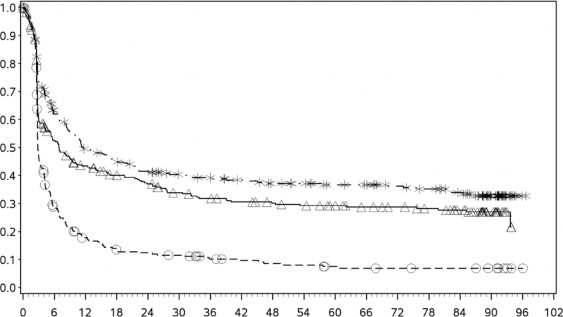
Progresyonsuz sağkalım (aylar)
Risk altındaki gönüllülerin sayısı | |||||||||||||||||
Nivolumab + ipilimumab | |||||||||||||||||
- - -* Nivolumab+ipilimumab (olaylar: 189/314), medyan ve %95 GA: 11,50 (8,90, 20,04).
12 ayda PFS oranı ve % 95 GA: %49 (44, 55), 60 ayda PFS oranı ve % 95 GA: %36 (32,
42), 90 ayda PFS oranı % 95 GA: %33 (27,39)
ââââââ Nivolumab (olaylar: 208/316), medyan ve %95 GA: 6,93 (5,13; 10,18)
12 ayda PFS oranı ve % 95 GA: %42 (36, 47), 60 ayda PFS oranı ve % 95 GA: %29 (24,
35), 90 ayda PFS oranı % 95 GA: %27 (22,33)
- - -ï¦ İpilimumab (olaylar: 261/315), medyan ve %95 GA: 2,86 (2,79, 3,09).
12 ayda PFS oranı ve % 95 GA: %18 (14, 23), 60 ayda PFS oranı ve % 95 GA: %8 (5,
12), 90 ayda PFS oranı ve %95 GA CI: %7 (4,11)
İpilimumab karşısında nivolumab+ipilimumab -tehlike oranı ve %95 GA: 0,42 (0,35, 0,51)
İpilimumab karşısında nivolumab -tehlike oranı ve %95 GA: 0,53 (0,44, 0,64)
Nivolumab karşısında nivolumab+ipilimumab - tehlike oranı ve %95 GA: 0,79 (0,65, 0,97)
İpilimumaba (primer analiz) karşı Nivolumab+İpilimumab - HR (%99,5 GA): 0,42 (0,32-0,56); p- değeri: < 0,0001
İpilimumaba karşı Nivolumab (primer analiz) - HR (%99,5 GA): 0,55 (0,42-0,73); p-değeri: < 0,0001 Nivolumaba karşı Nivolumab+İpilimumab (tanımlayıcı analiz) - HR (%95 GA): 0,76 (0,62-0,95)
Şekil 3: PD-L1 ekspresyonuna göre progresyonsuz sağkalım: %5 eşik (CA209067)
Progresyonsuz sağkalım olasılığı
PD L1 ekspresyonu < %5
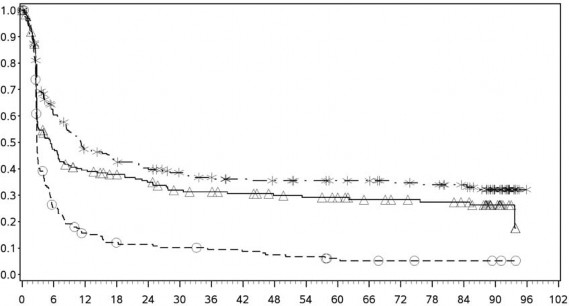
Progresyonsuz sağkalım (aylar)
Risk altındaki gönüllülerin sayısı |
Nivolumab + ipilimumab |
- - -*- - - - Nivolumab+ipilimumab (olaylar: 127/210), medyan ve %95 GA: 11,17 (7,98, 17,51)
ââââââ Nivolumab (olaylar: 139/208), medyan ve %95 GA: 5,39 (2,96, 7,13)
- - -ï¦- - - İpilimumab (olaylar: 171/202), ), medyan ve %95 GA: 2,79 (2,76, 3,02)
İpilimumab karşısında nivolumab+ipilimumab tehlike oranı ve %95 GA: 0,42 (0,33, 0,53)
İpilimumab karşısında nivolumab - tehlike oranı ve %95 GA: 0,54 (0,43, 0,68)
Nivolumab karşısında nivolumab +ipilimumab tehlike oranı ve %95 GA: 0,77 (0,61, 0,98)
Progresyonsuz sağkalım olasılığı
PD-L1 ekspresyonu ≥ %5
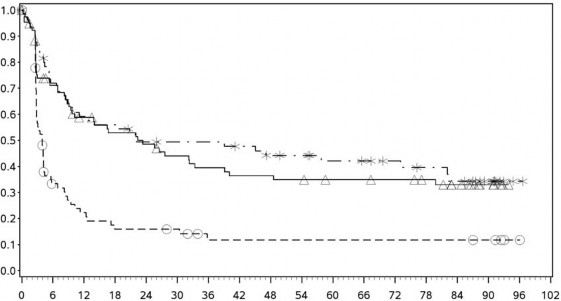
Progresyonsuz sağkalım (aylar)
Risk altındaki gönüllülerin sayısı | |||||||||||||||||
Nivolumab + ipilimumab |
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
- -* Nivolumab+ipilimumab (olaylar: 36/68), medyan ve %95 GA: 22,11 (9,72, 82,07)
ââââââ Nivolumab (olaylar: 48/80), medyan ve %95 GA: 22,34 (9,46, 39,13)
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Yeterli veri mevcut değildir.
Dağılım:
Yeterli veri mevcut değildir.
Biyotransformasyon:
Nivolumabın metabolik yolağı karakterize edilmemiştir. Tamamen insan IgG4 monoklonal antikoru olan nivolumabın, endojen IgG ile aynı şekilde katabolik yolaklar aracılığıyla küçük peptidlere ve amino asitlere bozunması beklenmektedir.
Eliminasyon:
Nivolumabın klirensi (CL) zaman içinde azalmaktadır ve başlangıç değerlerine göre meydana gelen ortalama maksimal azalma (% varyasyon katsayısı [%CV]) %26'dır (%32,6) ve bu, metastatik tümörlere sahip hastalarda 7,91 mL/saatlik (%46) bir geometrik ortalama kararlı durum klirensi (CLss) (%CV) ortaya çıkarmaktadır; CLss'deki düşüş klinik açıdan anlamlı kabul edilmemektedir. Kararlı durumda metastatik melanom hastalarındakine kıyasla melanomun tamamen rezeke edilmiş olduğu hastalarda geometrik ortalama popülasyon klirensi %24 daha düşük olduğundan, bu hastalarda nivolumabın klirensi zaman içinde azalmamaktadır. Kararlı durumda geometrik ortalama dağılım hacmi (Vd) (%CV) 6,6 L'dir (%24,4), geometrik ortalama eliminasyon yarı ömrü ise (t1/2) 25 gündür (%55,4). 2 haftada bir 3 mg/kg dozunda uygulandığında nivolumabın kararlı durum konsantrasyonlarına 12. haftada ulaşılmıştır ve sistemik birikim yaklaşık 4 kat olmuştur.
30 dakikalık bir infüzyonun ardından öngörülen nivolumab maruziyeti 60 dakikalık bir infüzyonun ardından gözlenenle karşılaştırılabilir niteliktedir.
Nivolumabın klirensi (CL) artan vücut ağırlığı ile birlikte artmıştır. Vücut ağırlığına göre normalize edilmiş doz, geniş bir vücut ağırlığı aralığında (34-162 kg), aşağı yukarı tek düze bir kararlı durum dip konsantrasyonu ortaya çıkarmıştır.
Doğrusallık/Doğrusal Olmayan Durum:
Nivolumabın farmakokinetiği 0,1 ila 10 mg/kg'lık doz aralığında doğrusaldır.
cHL hastalarında nivolumab CL, KHDAK'ne göre yaklaşık %32 daha düşük olmuştur. Adjuvan Melanom hastalarında, ilerlemiş melanoma kıyasla nivolumab başlangıç CL yaklaşık
%40 daha düşüktü ve kararlı durum CL yaklaşık %20 daha düşüktü. Mevcut güvenlilik verilerine göre, CL'deki bu azalmalar klinik olarak anlamlı değildi.
İpilimumab ile kombinasyon halinde OPDIVO:
Nivolumab 1 mg/kg, ipilimumab 3 mg/kg ile kombinasyon halinde uygulandığında, nivolumab CL değeri %29, ipilimumab CL değeri %9 artmış ve bu artış klinik olarak anlamlı kabul edilmemiştir. Nivolumab 3 mg/kg, ipilimumab 1 mg/kg ile kombinasyon halinde uygulandığında, nivolumab CL değeri %1 artmış ve ipilimumab CL değeri %1,5 azalmış ve bu değişiklikler klinik olarak anlamlı görülmemiştir.
İpilimumab ile kombinasyon halinde uygulandığında, nivolumabın CL değeri anti-nivolumab antikorlarının varlığında %20 artmış ve ipilimumabın CL değeri anti-ipilimumab
antikorlarının varlığında %5,7 artmıştır. Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir.
İpilimumab ve kemoterapi ile kombinasyon halinde OPDIVO:
3 haftada bir nivolumab 360 mg, 6 haftada bir ipilimumab 1 mg/kg ve 2 kür kemoterapi ile kombinasyon halinde uygulandığında, nivolumab CL değeri yaklaşık %10 düşmüş ve ipilimumab CL değeri yaklaşık %22 artmış ve bu artış klinik olarak anlamlı kabul edilmemiştir.
Hastalardaki karakteristik özellikler:
Popülasyon FK analizinde nivolumab CL'sinde yaş, cinsiyet, ırk, solid tümör tipi, tümör boyutu ve hepatik yetmezliğe dayanarak herhangi bir fark tespit edilmemiştir. ECOG durumu, başlangıç glomerüler filtrasyon hızı (GFR), albümin, kilo ve hafif karaciğer yetmezliği nivolumab CL'sini etkilese de, bu etki klinik olarak anlamlı değildi.
Nivolumabın klasik Hodgkin lenfoma hastalarındaki CL'sinin KHDAK'li hastalardakine kıyasla yaklaşık %32 daha düşük olduğu belirlenmiştir. Mevcut güvenlilik verileri göz önünde bulundurulduğunda CL'deki bu azalma klinik açıdan anlamlı görülmemiştir.
Böbrek yetmezliği
Popülasyon FK analizlerinde böbrek yetmezliğinin nivolumab CL'si üzerindeki etkisi normal böbrek fonksiyonuna sahip olan hastalara kıyasla (GFR ≥ 90 mL/dakika/1,73 m2; n = 342) hafif (GFR < 90 ve ≥ 60 mL/min/1,73 m2; n = 379), orta (GFR < 60 ve ≥ 30 mL/min/1.73 m2; n = 179) veya şiddetli (GFR < 30 ve ≥ 15 mL/dak/1,73 m2; n = 2) böbrek yetmezliği olan hastalarda değerlendirilmiştir. Hafif veya orta şiddetli böbrek yetmezliği olan hastalarla normal böbrek fonksiyonuna sahip hastalar arasında nivolumab CL'sinde klinik olarak anlamlı farklar tespit edilmemiştir. Şiddetli böbrek yetmezliği olan hastalardan elde edilen veriler, bu popülasyonla ilgili bir sonuç çıkaramayacak kadar sınırlıdır (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Bir popülasyon FK analizinde karaciğer yetmezliğinin nivolumab CL'si üzerindeki etkisi normal karaciğer fonksiyonuna sahip hastalara kıyasla (toplam bilirubin ve AST ≤ ULN; n = 804) hafif karaciğer yetmezliği (Ulusal Kanser Enstitüsünün hepatik fonksiyon bozukluğu kriterleri kullanılarak tanımlandığı şekilde toplam bilirubin > 1 Ã ila 1,5 Ã ULN veya AST > ULN; n = 92) olan hastalarda değerlendirilmiştir. Hafif karaciğer yetmezliği olan hastalarla normal karaciğer fonksiyonuna sahip hastalar arasında nivolumab CL'sinde klinik olarak anlamlı farklar tespit edilmemiştir. Nivolumab, orta (toplam bilirubin > 1,5 Ã ila 3 Ã üst normal sınır [ULN] ve herhangi bir AST) veya şiddetli (toplam bilirubin > 3 Ã ULN ve herhangi bir AST) karaciğer yetmezliği olan hastalarda araştırılmamıştır (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum sitrat dihidrat Sodyum klorür Mannitol (E421) Pentetik asit Polisorbat 80
Sodyum hidroksit (pH ayarlaması için) Hidroklorik asit (pH ayarlaması için) Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları yapılmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır. OPDIVO, diğer ajanlarla aynı intravenöz hatta aynı zamanda infüze edilmemelidir.
6.3. Raf ömrü
Açılmamış flakon:
36 ay
Açıldıktan sonra:
Mikrobiyolojik nedenlerle, açılan tıbbi ürün derhal infüze edilmeli ya da seyreltilerek infüze edilmelidir.
Hemen kullanılmaması halinde OPDIVO'nun ışıktan korunduğunda 2ºC ila 8ºC'de kimyasal ve fiziksel kullanım içi stabilitesinin 24 saat, oda ışığı altında 20°C-25°C'de ise en fazla 8 saat olduğu gösterilmiştir (toplam 24 saatlik sürenin bu 8 saatlik periyoduna ürünün uygulandığı periyod dahildir).
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında saklayınız (2°C - 8°C). Dondurmayınız.
Işıktan korumak için orijinal ambalajında saklayınız.
Hazırlanan çözeltinin saklama koşulları için bölüm 6.3'e bakınız.
6.5. Ambalajın niteliği ve içeriği
Bir tıpası (bütil kauçuk) ve koyu mavi geçme kapağı (alüminyum) olan 10 mL flakonda (Tip 1 cam) 4 mL konsantre. Ambalaj boyutu 1 flakon.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikleriâne uygun olarak imha edilmelidir.
Hazırlama aşaması, özellikle asepsi ile ilgili, iyi uygulamalara ilişkin kurallara uygun olarak, eğitimli personel tarafından gerçekleştirilmelidir.
Hazırlama ve uygulama Dozun hesaplanması Nivolumab monoterapisi:
Hasta için reçete edilen doz mg/kg cinsinden verilir. Reçete edilen bu doza dayanılarak uygulanacak toplam doz hesaplanır. Hastaya tam doz uygulanabilmesi için birden fazla OPDIVO flakonu gerekli olabilir.
Mg olarak toplam OPDIVO dozu = kg olarak hastanın ağırlığı x mg/kg olarak reçete edilen doz.
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Bristol-Myers Squibb İlaçları Inc.
| Geri Ödeme Kodu | A16775 |
| Satış Fiyatı | 12322.69 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 12322.69 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699726765007 |
| Etkin Madde | Nivolumab |
| ATC Kodu | L01XC17 |
| Birim Miktar | 40/4 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Porto riko ) ve Beşeri bir ilaçdır. |