NOVOEIGHT 3000IU enjeksiyonluk çözelti hazırlamak için toz ve çözücü Kısa Ürün Bilgisi
{ Rekombinant Insan Koagulasyon Faktoru VIII }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
NovoEight® 3000 IU enjeksiyonluk çözelti hazırlamak için toz ve çözücü Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir toz flakonu nominal olarak 3000 IU turoktokog alfa (rekombinant insan koagülasyon faktörü VIII) içerir.
NovoEight®, rekonstitüye edildikten sonra yaklaşık olarak 750 IU/mL turoktokog alfa (rekombinant insan koagülasyon faktörü VIII) içerir.
Potens (IU), Avrupa Farmakopesi (Ph.Eur) kromojenik tayin kullanılarak belirlenir. NovoEight®'in spesifik aktivitesi yaklaşık 8,300 IU/mg proteindir.
Turoktokog alfa (rekombinant insan koagülasyon faktörü VIII), 1,445 amino aside ve yaklaşık 166 kDA molekül kütlesine sahip saflaştırılmış bir proteindir. Çin hamsterı yumurtalık (CHO) hücrelerinde rekombinant DNA teknolojisi kullanılarak üretilir ve hücre kültürü prosesinde, saflaştırma ya da son formülasyon sırasında herhangi bir insan veya hayvan kaynaklı protein ilavesi olmaksızın hazırlanır.
Turoktokog alfa, amino asit sekansında başka bir modifikasyonu olmayan bir B-domain trunkat rekombinant insan koagülasyon faktörü VIII'dir (B-domaini, yabanıl tip B-domaininin 21 amino asidini içerir).
Yardımcı maddeler
Toz
Sodyum klorür 36 mg/mL Sodyum hidroksit (pH ayarı için) y.m.
Çözücü
Sodyum klorür 9 mg/mL Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti için toz ve çözücü.
Beyaz veya hafif sarı toz veya ufalanabilir kütle. Berrak ve renksiz enjeksiyonluk çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Hemofili A (konjenital faktör VIII eksikliği) hastalarının kanama tedavisinde ve
profilaksisinde kullanılır.
NovoEight® tüm yaş gruplarında kullanılabilir.
4.2. Pozoloji ve uygulama şekli
Tedavi hemofili tedavisinde deneyimli bir hekimin gözetimi altında olmalıdır. Tedavinin izlenmesi
Tedavi süresince, uygulanacak dozun ve tekrar edilen infüzyon sıklığının belirlenmesinde, faktör VIII seviyelerinin uygun şekilde tespit edilmesi önerilir. Her bir hasta, faktör VIII'e farklı yanıt verebilir, farklı yarılanma ömrü ve geri kazanım (recovery) gösterebilir. Vücut ağırlıkları normalden düşük veya fazla olan hastalarda vücut ağırlığına göre ayarlama yapılması gerekebilir. Yetişkin hastalardaki tek dozlu bir farmakokinetik çalışmada, maksimum maruz kalım (C) ve toplam maruz kalım (EAA), artan vücut kitle indeksi (VKİ) ile birlikte artmış olup, doz ayarlamasının gerekli olabileceğini göstermektedir. Vücut ağırlıkları normalden az hastalarda (VKI <18,5 kg/m2) dozda artış ve obez hastalarda (VKİ
≥30 kg/m2) dozda azalma gerekebilir, ancak spesifik doz ayarlamaları önermek için yeterli bilgi bulunmamaktadır (bkz Bölüm 5.2).
Özellikle majör cerrahi müdahaleler söz konusu olduğunda, ikame tedavinin koagülasyon analizi ile (plazma faktör VIII aktivitesi) kesin şekilde izlenmesi gerekmektedir.
Hastaların kan numunelerinde faktör VIII tayini için in vitro tromboplastin zamanı (aPTT) esaslı tek aşamalı pıhtılaşma tayini kullanıldığında, plazma faktör VIII aktivitesi sonuçları hem aPTT reaktifi tipinden hem de tayinde kullanılan referans standarttan anlamlı derecede etkilenebilir. Ayrıca, aPTT esaslı tek aşamalı pıhtılaşma tayini ve Avrupa Farmakopesi'ne uygun olan kromojenik tayin ile elde edilen tayin bulguları arasında anlamlı çelişkiler olabilir. Bu durum, özellikle de laboratuarın ve/veya tayinde kullanılan reaktiflerin değiştirilmesi halinde önem taşımaktadır.
Pozoloji/uygulama sıklığı ve süresi:
Yerine koyma tedavisinin dozu ve süresi faktör VIII eksikliğinin şiddetine, kanamanın yeri ve boyutuna ve hastanın klinik durumuna bağlıdır.
Uygulanan faktör VIII ünitelerinin sayısı, faktör VIII ürünleri için mevcut WHO standardına ait Uluslararası Ünite (IU) ile ifade edilir. Faktör VIII'in plazmadaki aktivitesi yüzde (normal düzey insan plazmasına göre) ya da Uluslararası Ünite (plazmada faktör VIII için Uluslararası Standarda göre) şeklinde ifade edilir.
Bir Uluslararası Ünite (IU) faktör VIII aktivitesi, 1 mL normal insan plazmasında bulunan faktör VIII miktarına eşdeğerdir.
Kanadıkça tedavi
Gereken faktör VIII dozunun hesaplanmasında, kg vücut ağırlığı başına 1 Uluslararası Ünite
(IU) faktör VIII'in plazma faktör VIII aktivitesini 2 IU/dl artırdığı yönündeki gözlemsel/deneysel bilgi esas alınmaktadır. Gereken doz aşağıdaki formül kullanılarak hesaplanır:
Gereken ünite sayısı = vücut ağırlığı (kg) x istenen faktör VIII yükselmesi (%) (IU/dL) x 0,5 (IU/kg / IU/dL).
Uygulanacak miktar ve uygulama sıklığında her zaman söz konusu olgudaki klinik etkililik esas alınmalıdır.
Aşağıdaki hemorajik olaylar söz konusu olduğunda faktör VIII aktivitesi, karşılık gelen periyottaki belirli plazma aktivite düzeyinin (IU/dl veya normalin yüzdesi olarak) altına düşmemelidir. Kanama epizotlarında ve ameliyatlarda uygulanacak doza kılavuzluk etmesi için aşağıdaki tablo kullanılabilir:
Tablo 1 Kanama epizotlarında ve ameliyatlarda uygulanacak doz için kılavuz
Hemoraji derecesi/cerrahi prosedür tipi | Gereken FVIII düzeyi (%) (IU/dL) | Dozların sıklığı (saat)/Tedavinin süresi (gün) | ||
Hemoraji |
|
| ||
Erken dönem hemartroz, kas içine kanama veya ağız içi kanama | 20-40 | Ağrıyla beliren kanama epizodunda düzelme ya da iyileşme sağlanana kadar en az 1 gün her 12 ila 24 saatte bir tekrarlanır. | ||
Daha yaygın hemartroz, kas içine kanama veya hematom | 30-60 | İnfüzyon, 3 - 4 gün süreyle ya da ağrı ve disabilite düzelene kadar daha uzun süreyle her 12 - 24 saatte bir tekrarlanır. | ||
Yaşamı hemorajiler | tehdit | eden | 60-100 | İnfüzyon, tehdit giderilene kadar 8 - 24 saatte bir tekrarlanır. |
Cerrahi Diş çekimi cerrahi |
dahil |
minör |
30-60 |
24 saatte bir, en az bir gün, iyileşme sağlanana kadar |
Majör cerrahi | 80-100 (preoperatif ve postoperatif) | İnfüzyon 8-24 saatte bir yeterli yara iyileşmesi olana kadar tekrarlanır, ardından %30-60 faktör VIII aktivitesini sürdürmek üzere tedaviye en az 7 gün daha devam edilir. | ||
Profilaksi
Ağır hemofili A hastalarında kanamaya karşı uzun süreli profilaksi. Normal şartlar altında
önerilen dozlar, iki günde bir verilen kg vücut ağırlığı başına 20-40 IU faktör VIII ya da haftada üç kez verilen kg vücut ağırlığı başına 20-50 IU faktör VIII'dir.Erişkin ve adölesanlarda (>12 yaş) daha az sıklıkta dozaj (üç günde bir veya haftada 2 kez 40-60 IU/kg) uygulanabilir. Bazı durumlarda, özellikle daha genç hastalarda, daha kısa doz aralıkları veya daha yüksek dozlar gerekli olabilir.
Cerrahi
Pediyatrik hastalarda cerrahi ile ilgili kısıtlı deneyim bulunmaktadır.
Uygulama şekli:
İntravenöz kullanım.
NovoEight® için önerilen infüzyon hızı 1-2 mL/dakikadır. Hız, hastanın rahatlık düzeyine göre belirlenmelidir.
Uygulama öncesinde tıbbi ürünün rekonstitüsyonu (karışım halinde hazırlanması) üzerine
talimatlar için bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek yetmezliği olan hastalarda deneyim bulunmamaktadır.
Karaciğer yetmezliği olan hastalar klinik çalışmalara dahil edilmiştir. Bu hastalar ile karaciğer yetmezliği olmayan hastalar arasında etkililik ve güvenlilik açısından fark gözlenmemiştir.
Pediyatrik popülasyon:
12 yaşın altındaki hastalarda kanamaya karşı uzun süreli profilaksi için iki günde bir, kg vücut ağırlığı başına 25-50 IU faktör VIII ya da haftada 3 defa kg vücut ağırlığı başına 25-60 IU faktör VIII önerilmektedir. 12 yaşın üzerindeki pediyatrik hastalarda doz önerileri, erişkinlerdeki ile aynıdır.
Geriyatrik popülasyon:
65 yaşın üzerindeki hastalar ile ilgili deneyim bulunmamaktadır.
4.3. Kontrendikasyonlar
Etkin madde
Hamster proteinlerine karşı bilinen alerjik reaksiyon.
4.4. Özel kullanım uyarıları ve önlemleri
Aşırı duyarlılık
NovoEight® ile alerjik tip aşırı duyarlılık reaksiyonları olasıdır. Ürün, bazı hastalarda alerjik reaksiyonlara neden olabilen hamster proteinlerinden eser miktarlarda içerir. Aşırı duyarlılık semptomlarının ortaya çıkması halinde hastalara bu tıbbi ürünün kullanımını derhal durdurmaları ve hekimleri ile temasa geçmeleri tavsiye edilmelidir. Hastalar aşırı duyarlılığın kurdeşen, yaygın ürtiker, göğüs sıkışması, hırıltı, hipotansiyon ve anafilaksi gibi erken işaretleri konusunda bilgilendirilmelidir.
Şok durumunda, şok tedavisine yönelik mevcut tıbbi standartlar izlenmelidir.
İnhibitörler
Faktör VIII'e karşı nötralize edici antikor (inhibitörler) oluşumu, hemofili A hastalarının tedavisinde bilinen bir komplikasyondur. Bu inhibitörler genellikle faktör VIII prokoagülan aktiviteye yönelik olan IgG immünoglobülinleridir ve modifiye tetkik kullanılarak her ml plazmada Bethesda Ünitesi (BU) olarak ölçülür. İnhibitör gelişme riski, faktör VIII'e maruziyetin yanı sıra hastalığın şiddeti ile ilişkilidir ve bu risk ilk 50 maruziyet gününde en yüksek seviyededir; ancak risk yaygın görülmemesine rağmen yaşam boyu devam eder.
İnhibitör gelişiminin klinik önemi inhibitör titresine bağlı olacaktır; düşük titrenin teşkil ettiği yetersiz klinik yanıt riski, yüksek titreli inhibitörlere kıyasla daha az olacaktır. Genel olarak, koagülasyon faktörü VIII ürünleri ile tedavi edilen tüm hastalar, uygun klinik gözlem ve laboratuvar testleri ile inhibitörlerin gelişimi açısından dikkatle izlenmelidir. Eğer beklenen faktör VIII aktivitesinin plazma düzeylerine ulaşılamazsa veya yeterli doz ile kanama kontrol altına alınamazsa faktör VIII inhibitörü varlığı açısından test yapılmalıdır. İnhibitör düzeyleri yüksek olan hastalarda faktör VIII tedavisi etkili olmayabilir ve diğer tedavi seçenekleri dikkate alınmalıdır. Böyle hastaların tedavisi hemofili ve faktör VIII inhibitörleri tedavisi konusunda deneyimli hekimler tarafından yönlendirilmelidir.
Kardiyovasküler olay
Mevcut kardiyovasküler risk faktörleri olan hastalarda FVIII ile ikame tedavisi kardiyovasküler riski artırabilir.
Katetere bağlı komplikasyonlar
Eğer bir santral venöz erişim cihazı (CVAD) gerekli ise, lokal enfeksiyonlar, bakteriyemi ve kateter yeri trombozu gibi CVAD ile ilişkili komplikasyonlar riski göz önünde bulundurulmalıdır.
Hasta ve tıbbi ürünün serisi arasındaki bağlantının devam etmesi için, hastaya her NovoEight uygulamasında ürünün adı ve seri numarasının kaydedilmesi kesinlikle önerilir.
Pediyatrik popülasyon
Belirtilen uyarılar ve önlemler hem erişkinler hem de çocuklar için geçerlidir.
Yardımcı maddeler
Bu tıbbi ürün, rekonstitüye edilmiş flakon başına 30,5 mg sodyum ihtiva etmekte olup, Dünya Sağlık Örgütü (WHO) tarafından önerilen yetişkinler için maksimum günlük 2 g'lık sodyum alımın %1,5'ine eşdeğerdir.
İzlenebilirlik
Biyolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına açıkça kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İnsan koagülasyon faktör VIII (rDNA) ürünleri ile diğer tıbbi ürünler arasında bilinen bir etkileşim bulunmamaktadır.
Özel popülasyonlara ilişkin ek bilgiler
Pediyatrik popülasyon:
NovoEight® ile etkileşim çalışmaları gerçekleştirilmemiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) NovoEight®'in çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin herhangi bir bilgi bulunmamaktadır.
Gebelik dönemi
Hemofili genel olarak erkeklerde görüldüğünden, turoktokog alfanın gebe kadınlarda kullanımına ilişkin yeterli veri yoktur.
Hayvanlar üzerinde yapılan çalısmalar, gebelik /ve-veya/ embriyonal / fetal gelisim /ve veya/ doğum /ve-veya/ doğum sonrası gelisim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
NovoEight® gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Kadınlarda hemofili A'nın seyrek görülmesine bağlı olarak, emzirme süresince faktör VIII kullanımı ile ilgili deneyim bulunmamaktadır. Bu nedenle, faktör VIII laktasyon süresince sadece açıkça endike olduğunda kullanılmalıdır.
Üreme yeteneği/Fertilite
NovoEight®'in üreme yeteneği üzerindeki etkisine ilişkin bilgi bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
NovoEight®'in araç ve makine kullanımı üzerinde etkisi bulunmamaktadır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Aşırı duyarlılık ya da alerjik reaksiyonlar (bunlar arasında anjiyoödem, infüzyon bölgesinde yanma ve batma, titreme, sıcak basması, yaygın ürtiker, baş ağrısı, kurdeşen, kan basıncında düşme, letarji, bulantı, huzursuzluk, taşikardi, göğüste sıkışma hissi, karıncalanma, kusma, hırıltılı solunum yer alabilir) nadiren gözlenmiştir ve bazı olgularda şiddetli anafilaksiye kadar ilerleyebilir (şok dahil).
İlgili aşırı duyarlılık reaksiyonları ile birlikte, hamster proteinine karşı antikor gelişimi çok nadiren gözlenmiştir.
NovoEight® de dahil olmak üzere faktör VIII ile tedavi edilmiş hemofili A hastalarında nötralize edici antikorlar (inhibitörler) gelişebilir (bkz. Bölüm 5.1). Bu tür inhibitörler
oluşursa, durum, yetersiz klinik yanıt şeklinde kendini gösterebilir. Bu gibi durumlarda uzman hemofili merkezleriyle bağlantı kurulması önerilmektedir.
Advers reaksiyonların tablolaştırılmış listesi
Aşağıda verilen tablo, MedDRA sistem organ sınıflandırmasına (SOC ve Tercihli Terim
Düzeyi) uygundur.
Görülme sıklıkları şu yaklaşıma göre değerlendirilmiştir: çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000) ve bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her bir sıklık gruplamasında, istenmeyen etkiler, azalan ciddiyet sırasına göre sunulmaktadır.
Tablo 2 Klinik çalışmalardaki advers ilaç reaksiyonlarının sıklığı
Sistem organ sınıfı | Önceden tedavi görmüş hastalarda Sıklık | Önceden tedavi görmemiş hastalarda sıklık | Advers reaksiyon |
Kan ve lenf sistemi hastalıkları | Yaygın olmayan | Çok yaygın | Faktör VIII inhibisyonu |
Psikiyatrik hastalıklar | Yaygın olmayan |
| Uykusuzluk |
Sinir sistemi hastalıkları | Yaygın olmayan |
| Baş ağrısı, sersemlik hali, yanma hissi |
Kardiyak hastalıklar | Yaygın olmayan |
| Sinüs taşikardisi, akut miyokard enfarktüsü |
Vasküler hastalıklar | Yaygın olmayan |
| Hipertansiyon, lenfödem, hiperemi |
| Yaygın | Kızarma, yüzeysel trombofilebit | |
Deri ve deri altı doku hastalıkları |
| Yaygın | Döküntü ,eritematöz döküntü |
Yaygın olmayan |
| Döküntü, likenoid keratoz, ciltte yanma hissi | |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Yaygın olmayan |
| Kas-iskelet sertliği, artropati, ekstremite ağrısı, kas-iskelet ağrısı |
| Yaygın | Hemartroz, kas içi hemoraji | |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar |
| Yaygın | Öksürük |
Gastrointestinal sistem hastalıkları |
| Yaygın | Kusma |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Yaygın |
| Enjeksiyon yeri reaksiyonları |
| Yaygın | Pireksi, kateter bölgesinde eritem | |
Yaygın olmayan |
| Yorgunluk, sıcaklık hissi, periferik ödem, ateş |
Araştırmalar | Yaygın |
| Hepatik enzim düzeylerinde yükselme |
| Yaygın | Anti Faktör VIII antikor pozitif | |
Yaygın olmayan |
| Kalp atım hızında artış | |
Yaralanma, zehirlenme ve prosedüre bağlı komplikasyonlar |
|
|
|
Yaygın |
| Yanlış doz uygulanması | |
| Yaygın | İnfüzyona bağlı reaksiyon | |
Yaygın olmayan |
| Kontüzyon | |
Ürün kaynaklı problemler |
| Yaygın | Cihazda tromboz |
a Hesaplamalar, tüm klinik çalışmalardaki 242 önceden tedavi görmüş hasta ve 60 önceden tedavi görmemiş hastanın toplam sayısına dayanmaktadır (301).
b Sıklık, tüm FVIII ürünleriyle ilgili, ağır hemofili A hastalarının yer aldığı çalışmalara dayalıdır.
Enjeksiyon yeri reaksiyonları şunları içerir: enjeksiyon yerinde kızarıklık, enjeksiyon
yerinde ekstravazasyon ve enjeksiyon yerine kaşıntı.
4.9. Doz aşımı ve tedavisi
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antihemorajikler, kan koagülasyon faktörü VIII ATC kodu: B02BD02
Etki mekanizması
NovoEight®, kesilmiş B-domainli bir rekombinant insan koagülasyon faktörü VIII olan turoktokog alfa içerir. Bu glikoprotein aktive edildiğinde insan faktörü VIII ile aynı yapıya sahiptir ve post-translasyonel değişiklikler plazma türevli molekülün değişiklikleri ile benzerdir. von Willebrand faktörünün bağlanması için önemli olan Tyr1680 (doğuştan tam uzunlukta) noktasında mevcut olan tirozin sülfasyon bölgesinin turoktokog alfa molekülünde tamamen sülfatlanmış olduğu bulunmuştur. Hemofili hastasına infüze edildiğinde, faktör VIII hastanın dolaşımındaki endojen von Willebrand faktörüne bağlanır. Faktör VIII/von Willebrand faktörü kompleksi, farklı fizyolojik fonksiyonlara sahip iki molekülden oluşur (faktör VIII ve von Willebrand faktör). Aktive faktör VIII, aktive faktör IX için ko-faktör işlevi görerek faktör X'un aktive faktör X'a dönüşümünü hızlandırır. Aktive faktör X, protrombini trombine dönüştürür. Trombin daha sonra fibrinojeni fibrine dönüştürür ve pıhtı oluşabilir. Hemofili A, düşük faktör VIII:C düzeylerine bağlı olan ve eklemlerde, kaslarda veya iç organlarda spontan oluşan ya da kaza veya cerrahi travma sonucu ortaya çıkabilen ciddi kanamalara neden olan cinsiyet kromozomuna bağlı kalıtsal bir kan pıhtılaşma bozukluğudur. Replasman tedavisi ile faktör VIII'in plazma düzeyleri artırılır, böylelikle faktör eksikliği geçici olarak düzeltilir ve kanama eğilimleri giderilir.
Ayrıca, yıllık kanama oranı (ABR), farklı faktör konsantreleri ve farklı klinik çalışmalar arasında kıyaslanabilir değildir.
Klinik etkililik
NovoEight®'in ağır hemofili A (FVIII aktivitesi ≤%1) hastalarında kanamaların önlenmesi ve tedavisinde ve cerrahi müdahaleler sırasında güvenliliği ve etkililiğini değerlendirmek amacıyla dört çok merkezli, açık etiketli, kontrol grubu olmayan çalışma gerçekleştirilmiştir. Bu çalışmalardan üçü daha önce tedavi görmüş hastalarda, dördüncüsü daha önce tedavi görmemiş hastalarda gerçekleştirilmiştir. Bu çalışmalarda 298 hastaya ilaç uygulanmıştır; inhibitörü olmayan 12 yaş ve üzeri 175 adölesan ve erişkin hasta (≥150 maruziyet günü), inhibitörü olmayan 12 yaş altı daha önceden tedavi görmüş 63 pediyatrik hasta (≥50 maruziyet günü) ve daha önceden tedavi görmemiş 6 yaşın altındaki 60 hasta.
238 daha önceden tedavi görmüş hastanın 188'si güvenlilik uzatma çalışmasına devam etmiştir. NovoEight® ile tedavinin güvenli olduğu ve amaçlanan hemostatik ve önleyici etkiye sahip olduğu gösterilmiştir. Hastaların 298'inde gözlenen 3.293 kanamadan 2.902'si (%88,1) NovoEight®'in 1-2 infüzyonu ile düzelmiştir.
Tablo 3 Daha önceden tedavi edilmemiş hastalarda (HTGH) ve daha önceden tedavi edilmiş hastalarda (TGH) NovoEight tüketimi ve hemostatik başarı oranları
| Küçük çocuklar (0 ila <6 yaş) HTGH | Küçük çocuklar (0 ila <6 yaş) TGH | Büyük çocuklar (6 ila <12 yaş) TGH | Adölesanlar (12 ila <18 yaş) TGH | Erişkinler (≥ 18 yaş) TGH | Toplam |
Hasta sayısı | 60 | 31 | 32 | 24 | 151 | 298 |
Önlem için |
|
|
|
|
|
|
hasta başına |
|
|
|
|
|
|
kullanılan |
|
|
|
|
|
|
doz (IU/kg | 45,2 (14,4) | 41,5 (8.1) | 38,4 (9,4) | 28,5 (9,3) | 28,5 (8,3) | 32,8 (10,9) |
VA) | 4,5 ; 363,8 | 3.4 ; 196,3 | 3,2 ; 62,5 | 17,4 ; 73,9 | 12 ; 97,4 | 3,2 ; 363,8 |
Ortalama |
|
|
|
|
|
|
(SS) |
|
|
|
|
|
|
Min; Maks |
|
|
|
|
|
|
Kanama |
|
|
|
|
|
|
tedavisi için |
|
|
|
|
|
|
kullanılan |
|
|
|
|
|
|
doz (IU/kg | 43,6 (15,2) | 44 (12,6) | 40,4 (10,45) | 29,3 (10,3) | 35 (12,3) | 37,5 (13,4) |
VA) | 11,9 ; 118,9 | 21,4 ; 93,8 | 24 ; 71,4 | 12,4 ; 76,8 | 6,4 ; 104 | 6,4 ; 193,8 |
Ortalama |
|
|
|
|
|
|
(SS) |
|
|
|
|
|
|
Min; Maks |
|
|
|
|
|
|
Başarı oranı | %87 | %92,2 | %88,4 | %85,1 | %89,6 | %88,9 |
VA: Vücut ağırlığı, SS: Standart sapma
aBaşarı 'Mükemmel' ya da 'İyi' olarak tanımlanmaktadır.
Ruhsatlandırma öncesi klinik veriler, rutin klinik uygulamada NovoEight®'in immunojenesitesi, etkililiği ve güvenliliğine ilişkin ek dokümantasyon sağlamak amacıyla yürütülen, girişimsel olmayan, ruhsatlandırma sonrası bir güvenlilik çalışmasıyla desteklenmiştir. 14'ü 12 yaşın altında ve 54'ü 12 yaş ve üzerinde olan toplam 68 daha önceden tedavi görmüş hasta (> 150 maruziyet günü), toplamda 87,8 hasta yılı ve 8967 maruziyet günü süresince kanadıkça (N = 5) ve profilaktik (N = 63) tedavi almıştır.
Cerrahi
25 hastada toplam 30 cerrahi operasyon gerçekleştirilmiş olup bunların 26'sı majör ve 4'ü minör cerrahidir. Tüm cerrahi operasyonlarda hemostaz başarılı olmuştur ve tedavi başarısızlığı bildirilmemiştir.
Faktör VIII'e karşı inhibitör geliştiren hemofili A hastalarında İmmün Tolerans İndüksiyonu (ITI) hakkında veriler toplanmıştır. Daha önceden tedavi edilmemiş hastalardaki (HTGH) klinik çalışmalar sırasında, 21 hasta ITI ile tedavi edilmiş ve 18 hasta (%86) ITI'yı negatif inhibitör test sonucu ile tamamlamıştır.
5.2. Farmakokinetik özellikler
Genel özellikler
NovoEight ile yapılan tüm farmakokinetik (FK) çalışmalar, 50 IU/kg NovoEight' in i.v uygulamasından sonra önceden tedavi edilmiş ağır hemofili A (FVIII ≤%1) hastaları ile gerçekleştirilmiştir. Plazma örneklerinin analizi hem tek aşamalı pıhtılaşma testi hem de kromojenik yöntem ile yürütülmüştür.
NovoEight®'in FVIII:C tayinlerinde tayin performansı değerlendirilmiş ve piyasalarda yer alan tam uzunlukta bir rekombinant FVIII ürünü ile karşılaştırılmıştır. Bu çalışma, bu iki ürünle karşılaştırılabilir ve tutarlı sonuçlar alındığını ve NovoEight®'in plazmada, ayrı bir NovoEight® standardına gerek olmadan güvenilir bir şekilde ölçülebileceğini göstermiştir.
NovoEight®'in tek doz farmakokinetik parametreleri, pıhtılaşma testi için Tablo 4'te, kromojenik test için Tablo 5'te gösterilmektedir.
Emilim:
NovoEight intravenöz olarak, doğrudan damar içine uygulanır. Bu nedenle, emilim çalışmaları yapılmamıştır.
Dağılım:
Plazma FVIII aktivitesi, dağılım fazı belirgin olmayan bir mono-üstel bozunma ile azalır.
Tablo 4 Yaşa göre NovoEight'in (50 IU/kg) tek doz farmakokinetik parametreleri â tek
aşamalı pıhtılaşma testi â Ortalama (SS)
Parametre | 0 - <6 yaş | 6 - <12 yaş | ≥12 yaş |
n=14 | n=14 | n=33 | |
Ortalama (SS) | Ortalama (SS) | Ortalama (SS) | |
Artan toparlanma (IU/dl)/(IU/kg) | 1,8 (0,7) | 2 (0,4) | 2,2 (04) |
EAA ((IU*sa)/dl) | 992 (411) | 1109 (374) | 1526 (577) |
KL (mL/sa/kg) | 6,21 (366) | 5,02 (1,68) | 3,63 (1,09) |
t.(sa) | 7,65 (1,84) | 8,02 (1,89) | 11,00 (4,65) |
V(mL/kg) | 56,68 (26,43) | 46,82 (10.63) | 47,40 (9,21) |
C(IU/dl) | 100 (58) | 107 (35) | 123 (41) |
Ortalama alıkonma süresi (s) | 9,63 (2,5) | 9,91 (2,57) | 14,19 (5,08) |
C: Maksimum Faktör VIII aktivitesi
EAA: Faktör VIII aktivite zaman profili altındaki alan V:Kararlı haldeki dağılım hacmi
KL: Klerens
t= Terminal yarı-ömür
Biyotransformasyon:
Uygulanabilir değil.
Eliminasyon:
Plazma FVIII aktivitesi, mono-üstel bir düşüş ile elimine edilir.
Tablo 5 Yaşa göre NovoEight'in (50 IU/kg) tek doz farmakokinetik parametreleri â
Kromojenik test â Ortalama (SS)
Parametre | 0 - <6 yaş | 6 - <12 yaş | ≥12 yaş |
n=14 | n=14 | n=33 | |
Ortalama (SS) | Ortalama (SS) | Ortalama (SS) | |
Artan toparlanma (IU/dl)/(IU/kg) | 2,2 (0,6) | 2,5 (0,6) | 2,9 (0,6) |
EAA ((IU*sa)/dl) | 1223 (436) | 1437 (348) | 1963 (773) |
KL (mL/sa/kg) | 4,59 (1,73) | 3,7 (1) | 2,86 (0,94) |
t.(sa) | 9,99 (1,71) | 9,42 (1,52) | 11,22 (6,86) |
V(mL/kg) | 55,46 (23,53) | 41,23 (6) | 38,18 (10,24) |
C(IU/dl) | 112 (31) | 125 (27) | 163 (50) |
Ortalama alıkonma süresi (s) | 12,06 (1,9) | 11,61 (2,32) | 14,54 (5,77) |
C: Maksimum Faktör VIII aktivitesi
EAA: Faktör VIII aktivite zaman profili altındaki alan V:Kararlı haldeki dağılım hacmi
KL: Klerens
t= Terminal yarı-ömür
Farmakokinetik parametreler 6 yaşın altındaki pediyatrik hastalar ile 6 ila 12 yaş arası pediyatrik hastalar arasında benzer olmuştur. Pediyatrik hastalar ile erişkin hastalar arasında NovoEight®'in farmakokinetik parametrelerinde bir miktar değişkenlik gözlenmiştir. Hemofili A'lı erişkin hastalar ile karşılaştırıldığında pediyatrik hastalarda görülen daha yüksek KL ve daha kısa t., kısmen, daha genç hastalarda kilogram vücut ağırlığı başına daha yüksek olduğu bilinen plazma hacmine bağlı olabilir.
Farklı VKİ kategorilerindeki 35 hemofili hastasında (≥18 yaş) tek dozlu bir farmakokinetik çalışma (50 IU/kg) yürütülmüştür. Artan VKİ ile maksimum maruz kalım (C) ve toplam maruz kalım (EAA) artmış olup, vücut ağırlıkları normalden düşük hastalarda (VKI <18,5 kg/m2) ve obez hastalarda (VKİ ≥30 kg/m2) doz ayarlaması gerekebileceğini göstermektedir, bkz Bölüm 4.2.
Tablo 6 VKI sınıflarınagöre NovoEight'in (50 IU/kg) tek doz farmakokinetik parametreleri âTek aşamalı pıhtılaşma testi â Ortalama (SS)
FK parametresi | Normalden az kiloda N=5 | Normal kiloda N=7 | Normalden fazla kiloda N=8 | Obez Sınıf I N=7 | Obez Sınıf II/III N=7 |
Artan toparlanma (IU/dl)/(IU/kg) |
1,7 (0,2) |
2 (0,2) |
2,4 (0,4) |
2,3 (0,3) |
2,6 (0,3) |
EAA ((IU*h)/dl) | 1510 (360) | 1920 (610) | 1730 (610) | 2030 (840) | 2350 (590) |
KL (ml/h/kg) | 3,91 (0,94) | 3,20 (1) | 3,63 (1,24) | 3,37 (1,79) | 2,51 (0,63) |
t(h) | 11,3 (2) | 11,7 (3,5) | 9,4 (2,9) | 11,2 (3,5) | 11,1 (2,7) |
V(ml/kg) | 56,8 (5,4) | 44,8 (6,5) | 39,6 (6) | 42 (9) | 35,0 (4,6) |
C(IU/dl) | 100 (11) | 121 (10) | 144 (26) | 140 (21) | 161 (32) |
Ortalama kalma süresi (h) | 15,1 (3) | 15,3 (4,8) | 11,9 (3,7) | 14,4 (4,6) | 14,6 (3,7) |
a VKİ grupları: Normalden az kilolu: VKİ <18,5 kg/m2, Normal kilolu: VKİ 18,5-24,9 kg/m2, Normalden fazla kilolu: VKİ 25-29,9 kg/m2, Obez Sınıf I: VKİ 30-34,9 kg/m2, Obez Sınıf II/III: VKİ ≥35 kg/m2.
b Sadece 6 hastaya dayanmaktadır.
Tablo 7 VKI sınıflarınagöre NovoEight'in (50 IU/kg) tek doz farmakokinetik parametreleri â Kromojenik test â Ortalama (SS)
FK parametresi | Normalden az kiloda N=5 | Normal kiloda N=7 | Normalden fazla kiloda N=9 | Obez Sınıf I N=7 | Obez Sınıf II/III N=7 |
Artan toparlanma (IU/dl)/(IU/kg) |
2,2 (0,4) |
2,9 (0,3) |
3 (0,5) |
3,2 (0,5) |
3,5 (0,5) |
EAA ((IU*h)/dl) | 1860 (700) | 2730 (860) | 2310 (1020) | 2780 (1210) | 3050 (730) |
KL (ml/h/kg) | 3,28 (0,87) | 2,25 (0,73) | 2,84 (1,09) | 2,58 (1,56) | 1,94 (0,52) |
t(h) | 11,7 (2,4) | 11,5 (3,6) | 9,7 (3,4) | 10,4 (3,2) | 10,5 (2,5) |
V(ml/kg) | 49,1 (10,4) | 31,2 (4,5) | 31,6 (5,8) | 28,9 (5,1) | 25,7 (4) |
C(IU/dl) | 138 (29) | 185 (24) | 194 (31) | 200 (33) | 227 (32) |
Ortalama kalma süresi (h) | 15,5 (3,2) | 15,2 (4,9) | 12,6 (4,8) | 13,5 (4,6) | 13,9 (3,7) |
a VKİ grupları: Normalden az kilolu: VKİ <18,5 kg/m2, Normal kilolu: VKİ 18,5-24,9 kg/m2, Normalden fazla kilolu: VKİ 25-29,9 kg/m2, Obez Sınıf I: VKİ 30-34,9 kg/m2, Obez Sınıf II/III: VKİ ≥35 kg/m2.
Doğrusallık/doğrusal olmayan durum:
Tüm farmakokinetik çalışmalar, 50 IU/kg dozundan sonra yapılmıştır. Bu nedenle, doz doğrusallığı araştırılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi ve tekrarlı doz toksisitesinden oluşan konvansiyonel çalışmalar bazında klinik dışı veriler, insanlar için endişeye neden olabilecek bir durum meydana getirmemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Toz:
Sodyum klorür L-histidin Sukroz Polisorbat 80 L-metiyonin
Kalsiyum klorür dihidrat Sodyum hidroksit (pH ayarı için) Hidroklorik asit (pH ayarı için)
Çözücü:
Sodyum klorür Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları bulunmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
Açılmamış flakon:
30 ay buzdolabında (2°C - 8°C) saklandığı sürece.
6.3. Raf ömrü
Ancak buzdolabından bir kere çıkarıldıktan sonra tekrar buzdolabına koyulmamalıdır. Saklamanın başladığı zaman ve saklama sıcaklığı ürün kutusu üzerine kaydedilmelidir.
Rekonstitüsyon sonrasında (kullanıma hazırlandıktan sonra):
Kullanıma hazırlandıktan sonraki kimyasal ve fiziksel stabilite aşağıdakiler için gösterilmiştir:
24 saat süreyle 2°C- 8°C'de saklanır.
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında saklanmalıdır (2°C - 8°C). Dondurulmamalıdır. Işıktan korumak için, flakon orijinal kutusunda saklanmalıdır.
Oda sıcaklığında (≤30°C) veya 40°C'ye kadar saklama ve tıbbi ürünün rekonstitüsyon sonrası saklama koşulları için bkz. bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Her NovoEight® 3000 IU enjeksiyonluk çözelti için toz ve çözücü ambalajı şunları içerir:
1 adet kauçuk (klorobütil) tıpalı flakon (tip I cam) içinde toz
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâ gereklerine uygun olarak imha edilmelidir.
NovoEight®, enjektör içinde verilen çözücü ile toz karıştırılarak hazırlandıktan sonra (rekonstitüye edilerek) intravenöz yolla uygulanır. Rekonstitüsyon sonrası çözelti berrak veya hafif opelesan görünümdedir. Bulanık görünen veya tortu içeren çözeltileri kullanmayınız.
Ayrıca bir infüzyon setine (ince tüp ve kelebek iğne), steril alkollü bezlere, gazlı bezlere ve
flasterlere ihtiyacınız olacaktır. Bunlar, NovoEight® ambalajında yer almaz. Her zaman aseptik teknik kullanınız.
Rekonstitüsyon
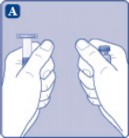
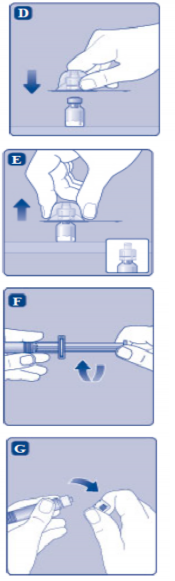
A) Flakonu, flakon adaptörünü ve kullanıma hazır enjektörü ambalajından çıkarınız. Piston koluna dokunmayınız ve kutu içinde bırakınız. Flakonun ve kullanıma hazır enjektörün oda sıcaklığına gelmesini sağlayınız. Bunu, elleriniz kadar ılık olana kadar elleriniz içinde tutarak yapabilirsiniz. Flakonu ve kullanıma hazır enjektörü ısıtmak için başka bir yol kullanmayınız. |
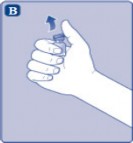
B) Plastik kapağı flakondan çıkarınız. Eğer plastik kapak gevşekse veya yoksa bu flakonu kullanmayınız. Flakondaki lastik tıpayı steril alkollü bez ile siliniz ve kullanmadan önce birkaç saniye kurumasını bekleyiniz. |
C)
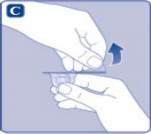
Koruyucu kağıdı flakon adaptöründen çıkarınız. Koruyucu kağıt tam kapalı değilse veya yırtıksa, bu flakon adaptörünü kullanmayınız.
Flakon adaptörünü koruyucu kapaktan parmaklarınızla çıkarmayınız.
D) Koruyucu kapağı ters çeviriniz ve flakon adaptörünü flakona takınız. Taktıktan sonra flakon adaptörünü flakondan çıkarmayınız. |
|
E) Koruyucu kapağı baş ve işaret parmağınızla şekilde gösterildiği gibi hafifçe sıkınız. Koruyucu kapağı flakon adaptöründen çıkarınız. |
|
F) Piston kolunu geniş üst kısmından kavrayınız ve piston kolunu hemen kullanıma hazır enjektör içindeki dalıcı pistona doğru, direnç hissedilene kadar saat yönünde çevirerek enjektöre bağlayınız. |
|
G) Delikli kısımdan kırılana kadar aşağı yönde eğmek suretiyle enjektör kapağını kullanıma hazır enjektörden çıkarınız. Enjektör kapağının altında bulunan enjektörün ucuna dokunmayınız. |
|
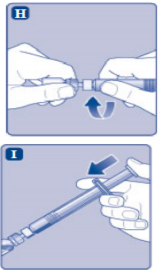
H) Kullanıma hazır enjektörü direnç hissedilene kadar çevirerek flakon adaptörüne sıkıca takınız. |
|
I) Kullanıma hazır enjektörü hafif eğik ve flakon aşağı bakacak şekilde tutunuz. Piston kolunu flakonun içine tamamen girene kadar itiniz. |
|
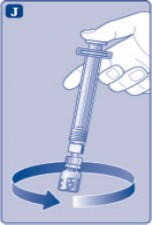
J)
Piston kolunu aşağıya doğru basılı tutunuz ve toz çözülene kadar flakonu dairesel hareketlerle döndürünüz. Köpüklenmeye yol açacağından flakonu çalkalamayınız.
Rekonstitüsyondan hemen sonra NovoEight®'in kullanılması önerilir. Rekonstitüye tıbbi ürünün saklama koşulları için bkz. bölüm 6.3.
Daha büyük bir doz gerekirse, A ile J arası adımları ek flakonlarla, flakon adaptörleri ve kullanıma hazır enjektörler ile tekrarlayınız.
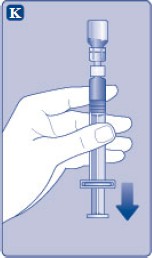
Rekonstitüye çözeltinin uygulanması
K) Piston kolunu tamamen içe basılı halde tutunuz. Flakon baş aşağı bakacak şekilde enjektörü çeviriniz. Piston kolunu itmeyi durdurunuz ve kendiliğinden geri hareket etmesine izin veriniz; bu esnada rekonstitüye çözelti enjektörü dolduracaktır. Rekonstitüye çözeltiyi enjektöre çekmek için piston kolunu hafifçe aşağı çekiniz.
Eğer dolu flakonun sadece bir kısmına ihtiyacınız varsa, doktorunuz veya hemşireniz tarafından size anlatıldığı gibi, rekonstitüye çözeltiden ne kadar çektiğinizi görmek için enjektör üzerindeki ölçeğe bakınız.
Hava kabarcıkları varsa bunların üst kısma yükselmesini sağlamak için, flakonu baş aşağı tutarken enjektöre parmaklarınızın ucuyla hafifçe vurunuz. Tüm hava kabarcıkları kaybolana kadar piston kolunu itiniz. |
L) Flakon adaptörünü flakon ile çevirerek açınız. |
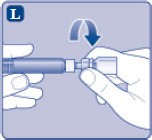
NovoEight® artık enjeksiyon için hazırdır. Uygun bir yer belirleyiniz ve NovoEight®'i damar
içine, 2-5 dakikalık bir sürede yavaşça enjekte ediniz.
İmha
Enjeksiyondan sonra kullanılmamış tüm NovoEight® çözeltisini, infüzyon setiyle birlikte enjektörü, flakon adaptörü ile birlikte flakonu ve diğer atık maddeleri eczacınızın tarif ettiği şekilde atınız.
Olağan ev atıkları ile birlikte atmayınız.
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ADYNOVATE | 8681429550509 | 7,489.19TL |
| BERIATE | 8699738980436 | |
| BERIATE-P | 8699738980481 | |
| ELOCTA | 8683125910038 | 13,330.57TL |
| EMOCLOT | 8680972009038 | 8,564.72TL |
| Diğer Eşdeğer İlaçlar |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
Novo Nordisk Sağlık Ürünleri Tic. Ltd. Şti.
| Satış Fiyatı | 26182.06 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 26182.06 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8699676790708 |
| Etkin Madde | Rekombinant Insan Koagulasyon Faktoru VIII |
| ATC Kodu | B02BD02 |
| Birim Miktar | 3000 |
| Birim Cinsi | IU |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > Koagülasyon Faktörü 8 |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |