DROSETIL 3 mg/0.03 mg 21 film kaplı tablet Kısa Ürün Bilgisi
{ Drospirenon + Ethinyl Estradiol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
DROSETİL 3 mg / 0.03 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet 3 mg drospirenon ve 0,03 mg etinilestradiol içerir. Yardımcı maddeler Her bir film kaplı tablet 62 mg laktoz monohidrat (sığır sütünden elde edilen şeker) içerir.Yardımcı maddeler
için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Yuvarlak, düz, sarı film kaplı tablet
Hafta: Tabletsiz dönemin yaklaşıyor olması nedeniyle güvenlilikte azalma riski yüksektir. Yine de, tablet alımında ayarlamalar yapılarak kontraseptif korumada azalma önlenebilir. Eğer unutulan tabletten önceki 7 gün boyunca tabletler doğru olarak alındıysa, aşağıdaki iki seçenekten birinin uygulanmasıyla ek bir kontraseptif yönteme gerek kalmaz; aksi takdirde bu seçeneklerden ilki seçilip, ayrıca 7 gün boyunca ek önlemler alınması gerekir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Gebeliği önleyici etkisinin yanı sıra antimineralokortikoid ve antiandrojenik etkileri sayesinde, hormona bağlı su tutulması ve buna bağlı belirtilerle, akne ve seboreden yakınan kadınlarda etkilidir.
DROSETİL reçete etme kararı, venöz tromboembolizmi (VTE) olan kadınlar başta olmak üzere her kadının mevcut risk faktörleri ve DROSETİL ile ortaya çıkan VTE riskinin diğer kombine hormonal kontraseptifler (KHK) ile karşılaştırması (bkz. Bölüm 4.3 Kontrendikasyonlar ve Bölüm Özel kullanım uyarıları ve önlemleri) dikkate alınarak verilmelidir.
4.2. Pozoloji ve uygulama şekli
Kombine oral kontraseptifler (KOK), doğru şekilde kullanıldıklarında yılda yaklaşık % 1 başarısızlık oranına sahiptir. İlaç unutulduğunda ya da yanlış kullanıldığında başarısızlık oranı artabilir.
Tabletler paketin üstünde gösterildiği sırayla, her gün yaklaşık aynı zamanda bir miktar suyla alınmalıdır. Birbirini izleyen 21 gün boyunca her gün bir tablet alınır. Her bir sonraki pakete 7 günlük, sıklıkla çekilme kanamasının izlendiği, tablet alınmayan dönemi takiben geçilir. Bu kanama genellikle son film kaplı tabletin alınmasını takiben 2.-3. gün başlar ve bir sonraki pakete başlandığında kesilmemiş olabilir.
Uygulama şekli:
Oral kullanım
DROSETİL'e başlangıç
Bir önceki ay hormonal kontraseptif kullanımı yoksa: Tablet alımına kadının normal siklusunun ilk günü (kanamasının ilk günü) başlanmalıdır. Tabletlere 2. ile 5. günler arasında başlanması da kabul edilebilir, ancak bu durumda ilk siklus için tablet alınmaya başlanmasından itibaren yedi gün boyunca ilave olarak bir bariyer kontrasepsiyon yöntemi kullanılmalıdır.
Bir KHK'dan geçiş (KOK, vajinal halka, transdermal flaster)
Kullanıcı tercihen, bir önceki KOK'un son tabletini (hormon içeren son tablet) aldığı günü izleyen günde DROSETİL'e başlamalıdır. En geç, önceki KOK'un tabletsiz döneminin veya hormon içermeyen tablet döneminin ertesi gününde başlayabilir. Vajinal halka ya da transdermal flaster kullanılması durumunda, kullanıcı halka ya da flasterin çıkarıldığı gün ya da en geç bir sonraki uygulamanın yapılması gereken gün DROSETİL'e başlamalıdır.
Yalnız progestajen içeren bir yöntemden (minipil, enjeksiyon, implant) ya da progestajen salımlı rahim içi sistemden (RİS) geçiş
Minipilden herhangi bir günde, (implant veya RİS'in çıkarıldığı gün, enjeksiyonda ise bir sonraki enjeksiyonun yapılması gereken gün) geçiş yapılabilir. Ancak tüm bu koşullarda tablet alımının ilk 7 günü ek bir bariyer yöntemi kullanılması önerilir.
İlk trimester düşüğünden sonra
Hemen başlanabilir. Bu durumda ek kontraseptif yöntemlere ihtiyaç duyulmaz.
Doğumdan ya da ikinci trimester düşüğünden sonra
(Emziren kadınlar için bkz. Gebelik ve laktasyon) Emzirmeyen kullanıcı doğum veya ikinci trimester düşüğünü takip eden 21.-28. günlerde başlaması konusunda uyarılmalıdır. Eğer daha geç başlanacaksa tablet kullanımının ilk yedi gününde ek bir bariyer yöntemi önerilir. Ancak daha önce bir cinsel birleşme olduysa, oral kontraseptife başlamadan önce gebelik ekarte edilmeli ya da kullanıcı bir sonraki kanama dönemini beklemelidir.
Tablet alımı unutulduğunda
Eğer kullanıcı tabletini almakta 12 saatten daha az geç kalmışsa, kontraseptif koruyuculuk azalmaz. Hatırlanır hatırlanmaz tablet alınmalı ve bir sonraki tabletler de her zamanki gibi alınmaya devam edilmelidir. Eğer 12 saatten daha fazla gecikme olmuşsa kontraseptif koruyuculuk azalmış olabilir. Bu durumda 2 temel kural uygulanır:
Tablet alımına hiçbir zaman 7 günden fazla ara verilmez.
4.3. Kontrendikasyonlar
KOK'lar aşağıdaki koşulların varlığında kullanılmamalıdır ve ilk kez KOK kullanımı sırasında bunlardan herhangi biri ortaya çıkacak olursa, tedavi hemen kesilmelidir.
VTE varlığı veya riski
Venöz tromboembolizm-mevcut VTE (antikoagülanlar üzerinde) veya öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE])
4.4. Özel kullanım uyarıları ve önlemleri
)Uyarılar
Epidemiyolojik çalışmalar, drospirenon içeren kombine oral kontraseptifler (KOK) için VTE riskinin, levonorgesterol içeren KOK'lardan (ikinci jenerasyon olarak bilinen preparatlar) daha fazla olduğunu ve bu riskin desogestrel/gestoden içeren KOK'lar (üçüncü jenerasyon olarak bilinen preparatlar) ile benzer olabileceğini göstermiştir.
Aşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, DROSETİL'in uygun
olup olmadığı kadın ile tartışılmalıdır.
Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk defa ortaya çıkması halinde, kadının DROSETİL kullanımının sonlandırılmasının gerekli olup olmadığının belirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir.
Şüpheli veya onaylanmış VTE veya ATE durumunda, KHK kullanımı kesilmelidir. Antikoagülan tedaviye başlandığında, antikoagülan tedavinin (kumarin) teratojenisitesi nedeniyle, yeterli alternatif kontrasepsiyon başlatılmalıdır.
Dolaşım bozuklukları
VTE riski
KHK kullanan kadınlarda VTE riski kullanmayanlara göre artar. Levonorgestrel, norgestimat veya noretisteron içeren ürünler en düşük VTE riski ile ilişkilendirilmiştir. Drospirenon/etinilestradiol kombinasyonu içeren diğer ürünlerde ise bu riskin iki katına kadar çıkabilir. En düşük VTE riskine sahip olduğu bilinenlerden farklı bir ürünün kullanılması kararı, ancak kadının KHK'lerle ilişkili VTE riskini, mevcut risk faktörlerinin bu riski nasıl etkilediğini ve VTE riskinin kullanımının ilk yılında en yüksek olduğunu anladığından emin olduktan sonra alınmalıdır. Ayrıca KHK kullanımına 4 hafta veya daha uzun süre ara verildikten sonra tekrar başlandığında riskin arttığını gösteren bazı kanıtlar vardır.
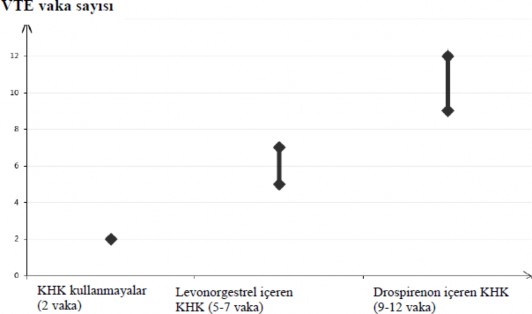
KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süre içinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlı olarak söz konusu risk çok daha yüksek olabilir (aşağı bakınız).
Drospirenon içeren KHK kullanan 10.000 kadından 9 ila 12'sinin bir yıl içinde VTE geliştireceği tahmin edilmektedir; bu oran levonorgestrel içeren KHK kullanan kadınlarda 6 civarındadır.
Düşük dozlu KHK'ler ile bir yıldaki VTE sayısı gebelikte veya postpartum dönemde kadınlarda beklenen sayıdan düşüktür.
VTE, bu vakaların %1-2'sinde ölümcül olabilir.
Bir yıl içinde her 10.000 kadında görülen VTE vakası sayısı
Son derece nadir olarak, KHK kullanıcılarında diğer kan damarlarında (örn. hepatik, mesenter, böbrek veya retinal toplardamarlar ve atardamarlar) tromboz meydana geldiği rapor edilmiştir.
VTE risk faktörleri
Venöz tromboembolik komplikasyon riski KHK kullanıcılarında özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (bkz. Tablo: VTE Risk faktörleri).
Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında DROSETİL kullanımı kontrendikedir (bkz. Bölüm 4.3 Kontrendikasyonlar). Bir kadın birden fazla risk faktörüne sahipse risk artışı tüm faktörlerin ayrı ayrı toplamından fazla olabilir ve bu durumda toplam VTE riski dikkate alınmalıdır. Fayda ve risk dengesinin negatif olduğu düşünülüyorsa KHK reçete edilmemelidir (bkz. Bölüm 4.3 Kontrendikasyonlar).
Tablo: VTE Risk faktörleri
Risk faktörü: | Açıklama |
Obezite (vücut kitle indeksi 30 kg/m'nin üstündeyse) | Vücut kitle indeksi yükseldiğinde risk ciddi ölçüde artar. Diğer risk faktörleri mevcutsa özellikle dikkate alınmalıdır. |
Uzun süreli hareketsizlik, majör cerrahi müdahale, bacaklara ve pelvise cerrahi müdahale, nörocerrahi, veya majör travma Not: 4 saatten fazla hava yolu seyahati dahil geçici hareketsizlik de özellikle diğer risk faktörleri olan kadınlarda VTE için bir risk faktörü olabilir. | Bu durumlarda ilacı kesmek (cerrahi müdahale durumunda en az 4 hafta) ve tamamen iyileştikten iki hafta sonrasına kadar devam etmemek önerilir. İstenmeyen gebeliği önlemek için başka bir kontrasepsiyon yöntemi kullanılmalıdır. Önceden DROSETİL kesilmemişse, antitrombotik tedavi düşünülmelidir. |
Pozitif aile geçmişi (Hiçbir ebeveyn ya da kardeşte erken yaşlarda (örn. 50 yaşından genç) VTE görülmemişse) | Kalıtsal bir eğilimden şüpheleniliyorsa, KHK kullanımından önce mutlaka bir uzmandan tavsiye alınmalıdır. |
VTE ile ilişkili diğer tıbbi durumlar | Kanser, sistemik lupus eritematoz, hemolitik üremik sendrom ve kronik inflamatuar bağırsak hastalıkları (Crohn hastalığı veya ülseratif kolit) ve orak hücre hastalığı. |
İlerleyen yaş | Özellikle 35 yaş üstü |
Variköz venlerin ve yüzeysel tromboflebitin venöz tromboembolideki olası rolü konusunda görüş birliği yoktur.
Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (bkz. bölüm Gebelik ve laktasyon).
VTE semptomları (DVT ve PE)
Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK
aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir.
DVT semptomları aşağıdakileri kapsayabilir:
bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme;
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Not: Olası etkileşimlerin tanımlanması için eşzamanlı ilaçların reçeteleme bilgilerine bakılmalıdır.
Diğer tıbbi ürünlerin DROSETİL ile etkileşimleri
Mikromozal enzimleri indükleyen ilaçlar ile arasındaki etkileşimler seks hormonu klirensinde artışa neden olabilir, bu durum da ara kanamaya ve/veya kontraseptif başarısızlığa yol açabilirler.
Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisinin kesilmesinin ardından 4 hafta kadar sürebilir.
Aşağıdaki etkileşmeler literatürde bildirilmiştir. Yukarıda belirtilen ilaçlardan herhangi biri ile kısa süreli tedavi edilmekte olan kadınlar, KOK dışında geçici olarak bir bariyer yöntemi kullanmalı ya da başka bir kontrasepsiyon yöntemi seçmelidirler. İlaçlar ile birlikte kullanımları süresince ve tedavinin kesilmesini takiben 28 gün boyunca bariyer yöntemi kullanmalıdırlar. Eğer bariyer yöntemi kullanılan dönem KOK kutusundaki tabletlerin bitiminden sonra devam ediyorsa, bir sonraki kutuya ara vermeden devam edilmelidir.
Karaciğer enzimini indükleyici etkin maddeler ile uzun süreli tedavi gören kadınlarda, başka
bir güvenilir, hormonal olmayan kontrasepsiyon yöntemi önerilmektedir.
Literatürde aşağıdaki etkileşimler bildirilmiştir.
KOK klirensini artıran maddeler (enzimlerin uyarılmasıyla KOK etkililiğinin azalması), örn.: Fenitoin, barbitüratlar, primidon, karbamazepin, rifampisin, bosentan ve HIV ilaçları ritonavir, nevirapin ve efavirenz ve muhtemelen oksakarbazepin, topiramat, felbamat, griseofulvin ve bitkisel ilaç Sarı Kantaron (hypericum perforatum) içeren ürünler.
KOK klirensi üzerine değişken etkilere sahip maddeler; örn;
KOK ile birlikte uygulandığında birçok HIV/HCV proteaz inhibitörü ve nükleozid olmayan ters transkriptaz inhibitörleri plazma östrojen veya progesteron konsantrasyonlarını azaltabilmekte ya da artırabilmektedir. Bu değişiklikler bazı olgularda klinik açıdan anlamlı
olabilir.
Bu nedenle, olası etkileşimleri ve ilgili önerileri tanımlamak için eşlik eden HIV / HCV ilaçlarının reçeteleme bilgilerine başvurulmalıdır. Herhangi bir şüphe durumunda, proteaz inhibitörü veya nükleosit olmayan ters transkriptaz inhibitörü tedavisi konusunda kadınlar tarafından ek bir bariyer kontraseptif metodu kullanılmalıdır.
KOK klirensini azaltan maddeler (enzim inhibitörleri)
Enzim inhibitörleriyle potansiyel etkileşimlerin klinik önemi bilinmemektedir.
Güçlü CYP3A4 inhibitörlerinin birlikte uygulanması, östrojen veya progestinin plazma konsantrasyonlarını veya her ikisini de artırabilir.
Azol antifungaller (ör. itrakonazol, vorikonazol, flukonazol), verapamil, makrolidler (ör.klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi kuvvetli ve orta düzeyde CYP3A4 inhibitörleri östrojen veya progesteron veya her ikisinin de plazma konsantrasyonunu artırabilir.
Drospirenon (3 mg/gün)/etinilestradiol (0,02 mg/gün) kombinasyonunun güçlü CYP3A4 inhibitörü ketakonazol ile 10 gün boyunca birlikte alımında drospirenonun ve etinilestradiolün EAA'sı (0-24 saat) sırasıyla 2,68 (90%CI: 2,44; 2,95) ve 1,40 kat (90%CI:
1,31, 1,49) artmıştır.
60-120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4-1,6 kat arttırdığı görülmüştür.
KOK'ların diğer tıbbi ürünler üzerine etkisi:
Oral kontraseptifler diğer bazı ilaçların metabolizmasını etkileyebilir. Buna bağlı olarak plazma ve doku konsantrasyonları artabilir (örn. siklosporin) ya da azalabilir (ör. lamotrigin).
İn vitro olarak, drospirenon P450 sitokrom enzimleri CYP1A1, CYP2C9, CYP2C19 ve
CYP3A4'ü zayıf ila orta düzeyde inhibe edebilir.
Omeprazol simvastatin veya midazolam kullanan gönüllü kadınlarda yürütülen in vivo etkileşim çalışmasında elde edilen sonuçlara göre drospirenonun 3 mg'lık dozlarda diğer ilaçların sitokrom P450 enzim aracılı metabolizmalarıyla klinik açıdan anlamlı bir etkileşim sergileme olasılığı bulunmamaktadır.
İn vitro etinilestradiol hem CYP2C19, CYP1A1 ve CYP1A2'nin geri döndürülebilir inhibitörü, hem de CYP3A4/5, CYP2C8, ve CYP2J2'nin mekanizma temelli inhibitörüdür.
Klinik çalışmalarda etinilestradiol içeren hormonal kontraseptifin uygulanması CYP3A4 substratlarının (ör. midazolam) plazma konsantrasyonlarında herhangi bir artışa yol açmaz ya da sadece zayıf bir artışa yol açarken, CYP1A2 substratlarının plazma konsantrasyonları hafif (ör. teofilin) veya orta düzeyde (ör. melatonin ve tizanidin) artabilmektedir.
Farmakodinamik etkileşimler
Ribavirin ile veya ribavirin olmadan, ombitasvir/paritaprevir/ritonavir ve dasabuvir içeren tıbbi ürünlerle eş zamanlı kullanım ALT yükselme riskini artırabilir (bkz. bölüm 4.3 Kontrendikasyonlar ve Özel kullanım uyarıları ve önlemleri). Bu nedenle, DROSETİL kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin, sadece progestajenle kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. DROSETİL, bu kombinasyon ilaç rejimi ile tedaviyi tamamladıktan 2 hafta sonra yeniden başlatılabilir.
Böbrek yetmezliği olmayan hastalarda, drospirenon ve ACE inhibitörleri veya NSAID birlikte kullanımı, serum potasyum üzerinde önemli bir etki göstermemiştir. Bununla birlikte, DROSETİL'in aldosteron antagonistleri veya potasyum koruyucu diüretiklerle birlikte kullanımı henüz çalışılmamıştır. Bu durumda, serum potasyum ilk tedavi döngüsü boyunca test edilmelidir. Ayrıca bkz. bölüm Özel kullanım uyarıları ve önlemleri.
Diğer etkileşmeler
Laboratuvar testleri
Kontraseptif steroidlerin kullanılması bazı laboratuvar testlerinin sonuçlarını etkileyebilir. Drospirenon hafif derecedeki antimineralokortikoid etkinliğine bağlı olarak, plazma renin etkinliğinde ve plazma aldosteronunda bir artışa neden olur.
Özel popülasyonlara ilişkin ek bilgiler
Böbrek yetmezliği: DROSETİL, ciddi böbrek yetmezliğinde ya da akut böbrek yetmezliğinde kullanılmamalıdır. Ayrıca â4.3 Kontrendikasyonlar' ve âFarmakokinetik özellikler' bölümüne bakınız.
Karaciğer yetmezliği: DROSETİL ağır karaciğer hastalığı durumunda kullanılmamalıdır.
Ayrıca â4.3 Kontrendikasyonlar' ve âFarmakokinetik özellikler' bölümüne bakınız. Pediyatrik popülasyon: DROSETİL yalnızca menarştan sonra endikedir. Doz ayarlamasına gerek olduğunu öneren herhangi bir veri bulunmamaktadır.
Geriyatrik popülasyon: Uygulanabilir değildir. DROSETİL menopozdan sonra endike
değildir.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon):
DROSETİL oral bir kontraseptiftir ve gebelik önleyici etkisi bulunmaktadır.
Gebelik dönemi:
DROSETİL gebelik döneminde kontrendikedir.
DROSETİL kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygın epidemiyolojik çalışmalar ne gebeliğinden önce KOK kullanmış olan kadınların çocuklarında doğumsal kusur riskinde herhangi bir artışı ne de erken gebeliği süresince yanlışlıkla KOK kullanıldığında oluşan bir teratojenik etkiyi göstermemiştir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve emzirme döneminde istenmeyen etkiler olduğunu göstermiştir (bkz. bölüm Klinik öncesi güvenlilik verileri). Bu hayvan verilerine dayanarak, aktif bileşiklerin hormonal etkisine bağlı istenmeyen etkiler göz ardı edilemez.
Bununla birlikte, gebelik sırasında KOKâlarla genel deneyim, insanlarda fiili bir istenmeyen
etkiye yönelik kanıt ortaya koymamıştır.
DROSETİL'in gebelikte kullanımına ilişkin veriler, DROSETİL'in gebelik, fötus ya da yenidoğanın sağlığı üzerindeki olumsuz etkileri hakkında sonuçlara varılmasına izin veremeyecek kadar kısıtlıdır. Konu hakkında epidemiyolojik veri henüz mevcut değildir.
DROSETİL kullanımına yeniden başlarken postpartum dönem sırasında artan VTE riski dikkate alınmalıdır (bkz. bölüm 4.2 Pozoloji ve uygulama şekli ve bölüm Özel kullanım uyarıları ve önlemleri).
Laktasyon dönemi:
KOK'ların kullanımı süt miktarında azalmaya ve sütün bileşiminde değişikliğe yol açabileceğinden dolayı laktasyon etkilenebilir. Bu yüzden emziren anne bebeğini sütten kesinceye kadar KOK kullanımı genellikle önerilmemelidir. Kontraseptif steroidler ve metabolitleri küçük miktarlarda süte geçebilir. Bu miktar bebeği etkileyebilir.
Üreme yeteneği / Fertilite:
DROSETİL, bir oral kontraseptiftir. Kullanıldığı sürece fertiliteyi engeller.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanma becerileri üzerinde etkisi ile ilgili herhangi bir çalışma yapılmamıştır. KOK kullanımının araç ve makine kullanma becerileri üzerinde herhangi bir etkisi gözlenmemiştir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
DROSETİL ile en sık bildirilen advers reaksiyonlar bulantı ve meme ağrısıdır. Kullanıcıların
%6'sından fazlasında görülür.
Ciddi advers reaksiyonlar ATE ve VTE'dir.
Advers reaksiyonların listesi
Drospirenon ve etinilestradiol kombinasyonu ile yapılmış klinik çalışmalarda (n=4897) bildirilen advers ilaç reaksiyonlarının sıklığı aşağıda özetlenmiştir. Her bir frekans grup içinde, advers ilaç reaksiyonları azalan ciddiyete göre sunulmuştur. Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır; çok yaygın (≥1/10), yaygın (â¥1/100, <1/10), yaygın olmayan (â¥1/1.000, <1/100), seyrek (â¥1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Sadece pazarlama sonrası gözlem sırasında tanımlanan ve sıklığı tahmin edilemeyen ilave advers ilaç reaksiyonları âbilinmiyorâ şeklinde listelenmiştir.
Bağışıklık sistemi hastalıkları
Seyrek: Aşırı duyarlılık, astım
Psikiyatrik hastalıkları
Yaygın: Duygu durum değişikliği, depresyon/depresif duygu durumu,
Yaygın olmayan: Libidonun azalması ya da kaybı
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Kulak ve iç kulak hastalıkları
Seyrek: Hipoakuzi
Vasküler hastalıkları
Yaygın: Migren
Yaygın olmayan: Hipotansiyon, hipertansiyon
Seyrek: Venöz ve arteriyel tromboembolik olaylar*
Gastrointestinal hastalıkları
Yaygın: Bulantı
Yaygın olmayan: Kusma, ishal
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Akne, egzema, kaşıntı, saç dökülmesi
Seyrek: Eritema multiforme, eritema nodozum
Üreme sistemi ve meme hastalıkları
Yaygın: Meme ağrısı, ara kanama, lekelenme, göğüslerde hassasiyet, vajinal deşarj,
vulvovajinal kandidiyazis
Yaygın olmayan: Meme büyümesi, vajinal enfeksiyon
Seyrek: Memede akıntı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın olmayan: Sıvı tutulumu, kiloda artış, kiloda azalma
Klinik çalışmalardaki advers olaylar MedDRA sözlüğü kullanılarak kodlanmıştır. Aynı tıbbi fenomeni temsil eden farklı MedDRA terimleri, doğru etkiyi hafifletmekten ya da örtbas etmekten kaçınmak amacıyla tek bir advers reaksiyon olarak birlikte gruplanmıştır.
* - Epidemiyolojik çalışmalardan tahmin edilen sıklık, KOK'lar grubunu kapsamaktadır.
Sıklık âçok seyrekâ sınırındadır.
- âVenöz ve arteriyel tromboembolik olaylarâ şu tıbbi durumları özetlemektedir: Periferik derin ven tıkanıklığı, tromboz ve embolizm/pulmoner vasküler tıkanıklık, tromboz, embolizm ve enfarktüs/miyokard enfarktüsü/serebral enfarktüs ve hemorajik olarak belirtilmeyen inme
Venöz ve arteriyel tromboembolik olaylar ve migren için â4.3 Kontrendikasyonlarâ, â4.4 Özel kullanım uyarıları ve önlemleriâ bölümlerine de bakınız.
Seçilmiş advers reaksiyonların tanımlanması
KHK kullanan kadınlarda Özel kullanım uyarıları ve önlemleri bölümünde daha ayrıntılı olarak ele alınmış miyokard infarktüsü, inme, geçici iskemik ataklar, venöz tromboz ve pulmoner emboli dahil olmak üzere arteriyel ve venöz trombotik ve tromboembolik olaylarda artış riski gözlemlenmiştir.
KOK'lar grubu ile ilgili olduğu düşünülen, sıklığı çok düşük olan ya da geç semptom başlangıcı olan advers reaksiyonlar aşağıda listelenmiştir. (â4.3 Kontrendikasyonlarâ, â4.4 Özel kullanım uyarıları ve önlemleriâ bölümlerine de bakınız.)
Bölüm 4.4 Özel tartışma ve kullanım önlemleri bölümünde tartışılan KOK kullanan
kadınlarda aşağıdaki ciddi advers olaylar bildirilmiştir:
Venöz tromboembolik bozukluklar
4.9. Doz aşımı ve tedavisi
DROSETİL'in doz aşımı ile ilgili klinik deneyim yoktur. KOK'ların kullanımı sonucu elde edilen deneyimlere göre KOK kullanımında görülebilecek belirtiler, bulantı, kusma ve gençlerde hafif vajinal kanamadır. Antidotu yoktur ve tedavisi semptomatik olmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Östrojenler ve progestajenler, fiks kombinasyonlar ATC kodu: G03AA12
KOK'ların kontraseptif etkisi ovülasyon inhibisyonu ve servikal salgıdaki değişiklikler gibi
birçok faktörün etkileşmesi ile ortaya çıkar.
Gebeliğe karşı koruma dışında, bazı olumsuz yönleri olmakla beraber (bkz. Özel kullanım uyarıları ve önlemleri, İstenmeyen etkiler) doğum kontrol yöntemine karar vermede yararlı olacak birçok olumlu yönü de vardır. Sikluslar daha düzenli, kanamalar sıklıkla daha az ağrılı ve hafiftir. Kanamaların hafifliği, demir yetmezliği oluşmasında azalmaya yol açar.
KOK kullanımı ile ilişkili VTE riski östrojen bileşeninden kaynaklanır. KOK'ların progesteron bileşeni tarafından VTE riski üzerinde herhangi bir modüle etki ettiği halen tartışılmaktadır. Etinilestradiol/drospirenon içeren KOK'ların levonorgestrel içeren KOK'lara kıyasla VTE risk artışını gösteren epidemiyolojik çalışmalar VTE riskinin hiç artmadığını veya 3 kata kadar arttırdığını gösteren farklı sonuçlar bildirmiştir. Çalışmaların çoğunda drospirenon/etinilestradiol kombinasyonu incelenmiştir.
Drospirenon, kontrasepsiyon dışında bazı yararlar sağlar. Antimineralokortikoid özelliği sayesinde, sıvı tutulması nedeniyle ortaya çıkan kilo artışı ve diğer belirtileri engeller. Östrojenin yol açtığı sodyum tutulmasını önleyerek, iyi bir toleransa ve premenstruel sendrom üzerinde olumlu etkilere yol açar. Drospirenon, etinilestradiol ile birlikte HDL'de artışa yol açarak lipid profilini olumlu etkiler. Antiandrojenik etkisi sayesinde deri üzerinde olumlu etkilere ve akne lezyonlarında ve deri yağlanmasında azalmaya yol açar. Ek olarak, drospirenon etinilestradiole bağlı seks hormonu bağlayıcı globulin (SHBG) artışını, dolayısıyla endojen androjenlerin bağlanması ve inaktive edilmesini engellemez.
Drospirenonun androjenik, östrojenik, glukokortikoid ve antiglukokortikoid etkinliği yoktur. Bu durum antimineralokortikoid ve antiandrojenik özellikleri ile, drospirenonun biyokimyasal ve farmakolojik profilinin doğal progesterona çok benzemesini sağlar. Bunların dışında, endometriyum ile yumurtalık kanserlerinde azalma gösterilmiştir. Ayrıca, daha yüksek dozlu KOK'ların (0,05 mg etinilestradiol) memenin fibrokistik tümörlerinde, yumurtalık kistlerinde, pelvik inflamatuvar hastalık ve ektopik gebelik sıklıklarında azalma sağladığı gösterilmiştir. Düşük doz KOK'larda da bu özelliğin geçerliliği henüz tam olarak saptanmamıştır.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerDrospirenon Emilim:
Ağızdan alınan drospirenon hızla ve hemen hemen tamamen emilir. Tek alımını takiben yaklaşık 1-2 saat sonra yaklaşık 38 ng/ml olan en yüksek etkin madde düzeyine ulaşılmıştır. Biyoyararlılığı yaklaşık % 76-85'dir. Gıdalarla birlikte alımı, biyoyararlanımı etkilemez.
Dağılım:
Drospirenon serum albuminine bağlanır. SHBG'e (seks hormonu bağlayıcı globulin) ya da CBG'ye (kortikoid bağlayıcı globulin) bağlanmaz. % 95-97'si non-spesifik olarak albumine bağlanırken, toplam serum konsantrasyonun yalnızca % 3-5'i bağlanmamış halde bulunur. Etinilestradiole bağlı SHBG yükselmesi drospirenonun serumda proteine bağlanmasını etkilemez. Drospirenonun dağılım hacmi yaklaşık 3,7±1,2 l/kg'dır.
Biyotransformasyon:
Drospirenon tam olarak metabolizasyona uğrar. Plazmada bulunan ana metabolitleri drospirenonun lakton halkasının açılmasıyla oluşturulan asit formu ve indirgenmenin ve bunu takiben sülfatasyonun oluşturduğu 4,5-dihidro-drospirenon-3-sülfattır. Her ikisi de P450 sistemi gerekmeden oluşurlar. Drospirenon, aynı zamanda CYP3A4 tarafından katalize edilen oksidatif metabolizmaya tabidir. Plazmadan klerens hızı yaklaşık 1,2-1,5 ml/dak./kg'dır.
Eliminasyon:
Drospirenon'un serum seviyeleri iki evrede azalır. Terminal dispozisyon evresi yaklaşık 31 saatlik yarılanma ömrü ile karakterizedir. Drospirenon değişmemiş olarak atılmaz. Metabolitleri halinde böbrek ve safradan 1,4/1,2 oranıyla atılır. Böbrek ve safrayla metabolitlerinin atılım yarılanma ömrü yaklaşık 1,7 gündür.
Doğrusallık / doğrusal olmayan durum:
Drospirenon farmakokinetiği, SHBG seviyelerinden etkilenmez. Günlük uygulamayı takiben, serum düzeyi, 2-3 kat artarak, tedavi siklusunun ikinci yarısı boyunca, sabit serum düzeyine ulaşır.
Hastalardaki karakteristik özellikler
Böbrek bozukluğunun etkisi:
Hafif düzeyde böbrek bozukluğu (kreatinin klerensi 50-80 ml/dak) olan kadınlar ile böbrek fonksiyonları normal olan (kreatinin klerensi>80 ml/dak) kadınların kararlı durum serum drospirenon düzeyleri karşılaştırılabilir sonuçlar vermiştir. Orta derecede böbrek bozukluğu (kreatinin klerensi 30-50 ml/dak) olan kadınların serum drospirenon düzeyleri böbrek fonksiyonu normal olan kadınlar ile karşılaştırıldığında %37 daha yüksek bulunmuştur. Drospirenon tedavisi tüm gruplar tarafından iyi tolere edilmiştir. Drospirenon tedavisi serum potasyum konsantrasyonu üzerine klinik olarak anlamlı bir etki göstermemiştir.
Karaciğer bozukluğunun etkisi:
Orta derecede hepatik fonksiyon bozukluğu olan kadınlarda (Child-Pugh B) ve hepatik fonksiyonu normal olan kadınlarda ortalama serum drospirenon konsantrasyon-zaman profilleri emilim/dağılım fazları süresince benzer Cdeğerleri elde edilerek karşılaştırılabilir bulunmuştur. Orta derecede hepatik bozukluğu olan gönüllülerde drospirenonun ortalama terminal yarılanma ömrü, normal hepatik fonsiyona sahip gönüllülere kıyasla 1,8 kat daha yüksektir.
Görünen oral klerens (CL/f) orta derecede hepatik bozukluğu olan gönüllülerde normal hepatik fonksiyona sahip gönüllüler ile karşılaştırıldığında %50 azalmıştır. Normal hepatik fonksiyona sahip gönüllülerle karşılaştırıldığında orta derecede hepatik bozukluğu olan
gönüllülerde gözlenen drospirenon klerensindeki azalma her iki grupta serum potasyum konsantrasyonlarında belirgin bir farklılık yaratmamıştır. Diyabet varlığı ve spironolakton tedavisi (hastanın hiperkalemi eğilimini artıran iki durum) de serum potasyum düzeylerini normal sınırın üzerine çıkarmamıştır. Sonuç olarak drospirenonun hafif ve orta derecede karaciğer bozukluğu olan hastalarda (Child-Pugh B) iyi tolere edildiği söylenebilir.
Etnik gruplar
Etnik faktörlerin drospirenon ve etinil estradiolün farmakokinetikleri üzerine etkileri genç, sağlıklı beyaz ve Japon kadınlarda tek ve yinelenen günlük oral uygulama sonrası araştırılmıştır. Sonuçlar, Japon ve beyaz kadınlar arasındaki etnik farklılıkların drospirenon ve etinilestradiolün farmakokinetikleri üzerine klinik olarak anlamlı etkisi olmadığını göstermiştir.
Etinilestradiol Emilim:
Ağızdan alınan etinilestradiol hızla ve tamamen emilir. En yüksek plazma düzeyleri olan 54-
100 pg/ml'ye 1-2 saat sonra ulaşılır. Emilim ve karaciğerden ilk geçiş esnasında etinilestradiol yoğun bir metabolizasyona uğrar ve yaklaşık % 20-65 gibi kayda değer bir ferdi değişkenlikle yaklaşık %45 ortalama oral biyoyararlılık ile sonuçlanır. Etinil estradiolle eş zamanlı gıda alımı, deneklerin %25'inde biyoyararlılıkta azalmaya yol açarken, diğerlerinde herhangi bir değişiklik görülmemiştir.
Dağılım:
Etinilestradiol serum albuminine yüksek oranda fakat non-spesifik olarak (yaklaşık %98) bağlanır ve karaciğerde CBG ve SHBG sentezini artırır. Dağılım hacmi yaklaşık 2,8-8,6 l/kg olarak bildirilmiştir.
Biyotransformasyon:
Etinilestradiol önemli bağırsak ve hepatik ilk geçiş metabolizmasına tabidir, esas olarak aromatik hidroksilasyon ile metabolize olur. Etinilestradiol ve oksidatif metabolitler öncelikle, glukronid veya sülfat ile konjuge olurlar. Metabolik klerens hızı 2,3-7 ml/dk/kg'dır.
Eliminasyon:
Etinilestradiol serum düzeyleri, yarı ömürleri sırasıyla 1 ve 10-20 saat olan, 2 dispozisyon evresinde azalır. Etinilestradiol değişmemiş olarak atılmaz. Metabolitler halinde böbrek ve safradan 4:6 oranında atılır. Metabolitlerin atılımının yarı ömrü yaklaşık 1 gündür.
Doğrusallık / doğrusal olmayan durum:
Bu düzeye tedavi siklusunun ikinci yarısında, serum ilaç seviyeleri, tek dozla
karşılaştırıldığında, % 40-110 oranında daha yüksek olduğunda ulaşılır.
5.3. Klinik öncesi güvenlilik verileri
Laboratuvar hayvanlarında, drospirenon ve etinilestradiolün etkileri bilinen farmakolojik etkiyle ilişkili olanlarla sınırlı kalmıştır. Özellikle, üreme toksisitesi çalışmaları türe özgü olarak değerlendirilen hayvanlarda embriyotoksik ve fetotoksik etkiler olduğunu ortaya çıkarmıştır. Drospirenon ve etinilestradiol kombinasyonu kullanıcılarındaki maruziyetin aşılmasıyla sıçan fetuslarında cinsel farklılaşma üzerinde etkiler geliştiği, maymunlarda bunun olmadığı gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (sığır sütünden elde edilen şeker) Mısır nişastası
Prejelatinize nişasta Krospovidon Povidon K-30 Polisorbat 80 Magnezyum stearat Opadry II sarı
Polivinil alkol
6.2. Geçimsizlikler
Herhangi bir geçimsizlik yoktur.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
25C'nin altında oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
PVC/PVDC-Alu blisterde 21 adet film kaplı tablet.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliğiâ
ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha
edilmelidir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| DROSETIL | 8681026050280 | 278.83TL |
| DROSMAX | 8699828091394 | |
| DROSMIN | 8699828091349 | |
| DROSPERA | 8681026050297 | 278.83TL |
| JERASSI | 8699578092016 | 330.59TL |
| Diğer Eşdeğer İlaçlar |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Exeltis İlaç San. ve Tic. Ltd Şti.
| Satış Fiyatı | 278.83 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 278.83 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681026050280 |
| Etkin Madde | Drospirenon + Ethinyl Estradiol |
| ATC Kodu | G03AA12 |
| Birim Miktar | 3+0,03 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Sistemik Hormonal Gebeliği Önleyici İlaçlar > Estradiol ve Drospirenon |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |