ADEPIRON 1gr/2ml 500mg/ml 10 ampül Kısa Ürün Bilgisi
{ Metamizol Sodyum }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ADEPİRON® l g/2 ml enjeksiyonluk çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Metamizol sodyum 1000 mg
Yardımcı maddeler
Yardımcı maddeler için Bkz. Bölüm 6. l
3. FARMASÖTİK FORMU
Enjeksiyonluk Çözelti Berrak, renksiz çözelti
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yaralanma veya cerrahi sonrası akut şiddetli ağrı
4.2. Pozoloji ve uygulama şekli
Doz ağrının veya ateşin şiddetine ve hastanın ADEPİRON®'a reaksiyon hassasiyetine bağlıdır. Öncelikli olarak ağrıyı ve ateşi kontrol edebilecek en düşük etkili doz tercih edilmelidir.
Çocuklarda ve 14 yaşına kadar adölesanlarda tek doz olarak vücut ağırlığının kg'ı başına 8-16 mg metamizol verilebilir. Ateş durumunda, çocuklar için genelde vücut ağırlığının kg'ı başına 10 mg yeterlidir. Yetişkinler ve 15 yaş ve üzerindeki adölesanlar (> 53kg) tek doz olarak 1000 mg alabilirler.
Maksimum günlük doza bağlı olarak, tek doz günde 4 kez, 6-8 saatlik aralarla alınabilir. Parenteral uygulamadan 30 dakika sonra belirgin bir etki beklenebilir.
Hipotansif reaksiyon riskini minimize etmek için intravenöz enjeksiyon çok yavaş uygulanmalıdır.
Aşağıdaki tablo ağırlığa veya yaşa bağlı olarak önerilen bir defalık doz ve maksimum günlük
dozu göstermektedir:
Vücut ağırlığı | Tek doz | Maksimum günlük doz | |||
kg | yaş | ml | mg | ml | mg |
5-8 | 3-11 aylık | 0,1-0,2 | 50-100 | 0,4-0,8 | 200-400 |
9-15 | 1-3 yaş | 0,2-0,5 | 100-250 | 0,8-2,0 | 400-1.000 |
16-23 | 4-6 yaş | 0,3-0,8 | 150-400 | 1,2-3,2 | 600-1.600 |
24-30 | 7-9 yaş | 0,4-1,0 | 200-500 | 1,6-4,0 | 800-2.000 |
31-45 | 10-12 yaş | 0,5-1,4 | 250-700 | 2,0-5,6 | 1.000-2.800 |
46-53 | 13-14 yaş | 0,8-1,8 | 400-900 | 3,2-7,2 | 1.600-3.600 |
> 53 | ≥ 15 yaş | 1,0-2,0 | 500-1.000 | 4,0-8,0 | 2.000-4.000 |
*Eğer gerekirse, tek doz 5 mL'ye (2500 mg metamizole eşdeğer) ve günlük doz 10 mL'ye (5000 mg metamizole eşdeğer) yükseltilebilir.
Uygulamanın süresi rahatsızlığın yapısına ve şiddetine bağlıdır. ADEPİRON® ile uzun süreli tedavi sırasında, diferansiyel kan sayımı da dahil olmak üzere düzenli kan sayımları gerçekleştirilmelidir.
Uygulama şekli:
İntravenöz veya intramusküler kullanım.
ADEPİRON®'un farklı farmasötik formları mevcuttur. Uygulama yolu seçimi, istenilen terapötik etkiye ve hastanın durumuna bağlıdır. Çoğu vakada tatmin edici bir etki elde etmek için oral uygulama yeterlidir. Hızlı analjezik etki gerektiğinde ya da oral veya rektal uygulamanın endike olmadığı durumlarda intravenöz veya intramüsküler uygulama tavsiye edilir. Oral kullanımı takiben 30 ila 60 dakikada ve parenteral uygulamayı takiben yaklaşık 30 dakikada belirgin bir etki beklenebilir.Uygulama yolu tercih edilirken, ilacın parenteral uygulamasının anafilaktik veya anafilaktoid reaksiyonlarda risk artışı ile ilişkili olduğu dikkate alınmalıdır.
ADEPİRON® intravenöz veya intramusküler yolla enjekte edilir. İntramusküler enjeksiyon her zaman vücut sıcaklığındaki bir solüsyon içinde uygulanmalıdır.
ADEPİRON® % 5 glukoz, % 0,9 salin veya Ringer's laktat solüsyonu ile karıştırılabilir veya seyreltilebilir. Bununla beraber, bu karışımların stabilitesi sınırlı olduğundan, infüzyon derhal uygulanmalıdır.
Geçimsizlik olasılığı göz önünde bulundurularak, ADEPİRON® enjeksiyonluk çözelti başka ilaçlarla beraber enjekte edilmemelidir.
Hızlı analjezik etki gerektiğinde ya da oral veya rektal uygulamanın endike olmadığı durumlarda intravenöz veya intramüsküler uygulama tavsiye edilir. Uygulama yolu tercih edilirken, ilacın parenteral uygulamasının anafilaktik veya anafilaktoid reaksiyonlarda risk artışı ile ilişkili olduğu dikkate alınmalıdır.
ADEPİRONenjeksiyonluk çözelti mutlaka hekim tavsiyesiyle kullanılmalıdır. İntravenöz uygulama hekim kontrolü altında yapılmalıdır.
Kullanım şekline ilişkin uyarılar:
Şok tedavisi için gerekli önlemler alınmalı, enjeksiyon solüsyonu vücut ısısına getirildikten sonra uygulanmalıdır.
Şiddetli kan basıncı düşüklüğü ile şok halinin ortaya çıkmasında en sık rastlanan sebep enjeksiyonların hızlı yapılmasıdır. Bu nedenle, ani kan basıncı düşmesine karşı intravenöz enjeksiyonlar hasta yatar durumdayken kan basıncı, nabız ve solunum kontrol altında tutulmak kaydıyla çok yavaş, dakikada 1 ml'yi geçmeyecek şekilde yapılmalıdır. Alerjik olmayan kan basıncı düşüklüğü doza bağlı olabileceği için 1 g'ın üzerindeki metamizol dozları ancak kesin bir endikasyon varsa kullanılmalıdır. ADEPİRON® enjeksiyon solüsyonu aynı enjektörde başka ilaçlarla karıştırılmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek ya da karaciğer bozukluğu olan hastalarda, metamizolün eliminasyon hızı azaldığı için tekrarlanan yüksek dozlardan kaçınılmalıdır. Yalnızca, kısa süreli tedavi için dozun azaltılması gerekmez. Şiddetli böbrek ya da karaciğer yetmezliği olan hastalarda uzun dönemli tedavi ile ilgili olarak kazanılmış yeterli deneyim mevcut değildir.
Pediatrik popülasyon:
ADEPİRON® enjeksiyonluk çözelti 3 aylıktan küçük bebeklere önerilmemektedir. 3 aylıktan küçük bebekler için dozun uygun bir şekilde verilebileceği başka farmasötik formlar mevcuttur.
Pediyatrik popülasyonda ağırlığa veya yaşa bağlı olarak önerilen bir defalık doz ve maksimum
günlük dozlar için yukarıdaki tabloya bakınız.
Geriatrik popülasyon:
Yaşlı hastalarda ADEPİRON® metabolizması ürünlerinin eliminasyonunda gecikme olabileceğinden, doz azaltılmalıdır.
Genel sağlık durumu bozuk olan ve kreatinin klirensi düşük olan hastalar:
Genel sağlık durumu bozuk olan ve kreatinin klirensi düşük olan hastalarda, ADEPİRON® metabolizması ürünlerinin eliminasyonunda gecikme olabileceğinden, doz azaltılmalıdır.
4.3. Kontrendikasyonlar
Metamizol ya da diğer pirazolonlara (örn. fenazon, propifenazon) veya pirazolidinlere (örn. fenilbutazon, oksifenbutazon) veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık (bu maddelerden birine karşı daha önceden agranülositoz gibi reaksiyonlar göstermiş hastaları da içerir)
4.4. Özel kullanım uyarıları ve önlemleri
ADEPİRON® pirazolon türevi olan metamizol içerir ve nadir ancak yaşamı tehdit edici olabilen şok ve agranülositoz riski taşır (Bkz. Bölüm 4.8).
ADEPİRON®'a karşı anafilaktoid reaksiyon gösteren hastalar, diğer narkotik olmayan analjeziklere karşı da aynı reaksiyonu gösterecek şekilde özellikle risk altındadırlar.
ADEPİRON®'a karşı anafilaktik veya immünolojik kaynaklı reaksiyon gösteren hastalar (örneğin agranülositoz), diğer pirazolonlar ve pirazolidinlere karşı da aynı reaksiyonu gösterecek şekilde özellikle risk altındadırlar.
Diğer pirazolonlara, pirazolidinlere ve diğer narkotik olmayan analjeziklere anafilaktik veya başka bir immünolojik reaksiyon gösteren hastalarda, ADEPİRON®'a de benzer şekilde reaksiyon gösterme riski yüksektir.
Agranülositoz:
Nötropeni (< 1,5 nötrofil/mm3) söz konusu olduğunda, tedavi derhal kesilmeli ve tam kan sayımı acil olarak kontrol edilmeli ve normal değerlere dönünceye değin izlenmelidir.
Tüm hastalara, aşağıdaki belirtilerden veya semptomlardan herhangi biri ortaya çıkarsa ilacı kesmeleri ve derhal doktorlarına danışmaları tavsiye edilmelidir: genel durumda beklenmedik bir bozulma (ateş, titreme, boğaz ağrısı, yutma güçlüğü gibi), kalıcı veya yeni ortaya çıkan ateş ve özellikle ağız, burun ve boğaz bölgesinde veya genital veya anal bölgede ağrılı mukoza değişikliklerinde ADEPİRON® kullanımı derhal kesilmeli ve kan sayımı izlenmelidir. (diferansiyel kan sayımı dahil). Laboratuvar testlerinin sonuçları beklenmeden tedavi kesilmelidir (bkz. Bölüm 4.8).
Trombositopeni
Deride ve mukoz membranlarda artan kanama eğilimi ve peteşi gibi trombositopeni belirtileri (bkz. bölüm 4.8) görülürse, ADEPİRON® kullanımı derhal durdurulmalı ve kan sayımı izlenmelidir (diferansiyel kan sayımı dahil). Tedavi laboratuvar testlerinin sonuçlarını beklemeksizin durdurulmalıdır.
Pansitopeni:
Pansitopeni ortaya çıkması halinde tedavi hemen kesilmeli ve kan değerleri normale dönene kadar tam kan sayımı ile takip yapılmalıdır (Bkz. Bölüm 4.8).
Bütün hastalar, metamizol kullanımı sırasında kan diskrazisinin göstergesi olabilecek belirti ve semptomların (örn. genel kırıklık, enfeksiyon, düşmeyen ateş, çürükler, kanama, solukluk) görülmesi halinde hemen doktora başvurmaları konusunda uyarılmalıdır.
Ağır deri reaksiyonları:
Nekroliz (TEN) gibi yaşamı tehdit eden deri reaksiyonları bildirilmiştir. SJS veya TEN belirti veya semptomlarının (genellikle içi sıvı dolu kabarcıklar veya mukoza lezyonlarının eşlik ettiği, giderek şiddetlenen deri döküntüleri gibi) gelişmesi halinde metamizol tedavisi hemen kesilmeli ve bir daha hiçbir zaman yeniden uygulanmamalıdır. Hastalar belirti ve bulgular konusunda bilgilendirilmeli ve özellikle tedavinin ilk haftalarında deri reaksiyonları yönünden sıkı takibe alınmalıdır.
Anafilaktik/Anafilaktoid reaksiyonlar:
Uygulama yolu seçilirken parenteral uygulamanın anafilaktik/anafilaktoid reaksiyonlar açısından daha yüksek bir risk taşıdığı göz önüne alınmalıdır.
Özellikle aşağıdaki hastalar metamizole karşı olası şiddetli anafilaktoid reaksiyonlar açısından özel bir risk altındadırlar (bkz. bölüm 4.3):
Anajezik astım sendromu veya ürtiker-anjiyoödem tipte analjezik intoleransı olan hastalar (Bkz. Bölüm 4.3)
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Metamizol serum siklosporin seviyelerini düşürebilir. Bu nedenle, ADEPİRON® ile eş zamanlı kullanıldığında bu değerler takip edilmelidir.
ADEPİRON® klorpromazinle birlikte kullanıldığında ağır hipotermi oluşabilir.
Pirazolonlar ile oral antikoagülanlar, kaptopril, lityum ve triamteren arasında etkileşimler olabildiği ve kombine kullanımda antihipertansiflerin ve diüretiklerin etkinliğinin değişebildiği bilinmektedir. Metamizolün bu etkileşimlere ne düzeyde neden olduğu bilinmemektedir.
Metotreksata metamizol eklenmesi, özelikle yaşlı hastalarda metotreksatın hematotoksisitesini artırabilir. Bu nedenle bu kombinasyondan kaçınılmalıdır.
Metamizol eş zamanlı alındığında asetilsalisilik asidin (aspirin) trombosit agregasyonu üzerindeki etkisini azaltabilir. Bu nedenle bu kombinasyon kardiyoproteksiyon amacıyla düşük doz aspirin kullanan hastalarda dikkatli kullanılmalıdır.
Metamizol bupropion kan konsantrasyonlarının düşmesine yol açabilir. Bu nedenle metamizol ve bupropionun eş zamanlı kullanımında dikkatli olunması önerilir.
Laboratuvar testleriyle etkileşim
Metamizol kullanan hastalarda, Trinder/Trinder-benzeri reaksiyonların kullanıldığı laboratuvar testleri (örneğin kreatinin, trigliseritler, HDL kolesterol ve ürik asit serum seviyelerini ölçmek için yapılan testler) ile etkileşim bildirilmiştir.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi: 1. ve 2. trimesterde C, 3. trimesterde X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadırlar.
Gebelik dönemi:
1.ve 2. trimester:
Metamizol'ün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm 5.3).
İnsanlara yönelik potansiyel risk bilinmemektedir.
ADEPİRON® gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
3. trimester:
Metamizol gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir. Metamizol gebelik döneminde kontrendikedir (bkz. Bölüm 4.3).
İlk trimesterde (n = 568) metamizole maruz kalan gebe kadınlara dair yayınlanan verilere göre, teratojenik veya embriyotoksik etkilere ilişkin bir kanıt saptanmamıştır. Seçili vakalarda, başka tedavi seçeneği olmadığında, birinci ve ikinci trimesterde tek doz metamizol kullanımı kabul edilebilir. Ancak genel olarak, birinci ve ikinci trimesterde metamizol kullanılması önerilmez. Üçüncü trimesterde metamizol kullanımı fetotoksisite (böbrek yetmezliği ve duktus arteriozus konstriksiyonu) ile ilişkilidir ve bu nedenle metamizol kullanımı gebeliğin üçüncü trimesterinde kontrendikedir (Bkz. Bölüm 4.3). Üçüncü trimesterde yanlışlıkla metamizol kullanılması durumunda amniyotik sıvı ve duktus arteriozus ultrason ve ekokardiyografi ile kontrol edilmelidir. Metamizol prostaglandin sentezinin sadece zayıf bir inhibitörü olmasına rağmen, fetal ve maternal trombosit agregasyonundaki azalmaya bağlı perinatal komplikasyon olasılığı göz ardı edilemez.
Metamizol, plasenta bariyerini geçer. Hayvanlarda metamizol üreme toksisitesini indüklemiş ancak teratojenite göstermemiştir (bkz. Bölüm 5.3).
Laktasyon dönemi:
Metamizolün parçalanma ürünleri kayda değer miktarda anne sütüne geçer ve emzirilen bebek için risk göz ardı edilemez. Özellikle emzirme döneminde tekrarlı şekilde metamizol kullanımından kaçınılmalıdır. Tek bir metamizol uygulaması durumunda, annelerin dozdan sonra 48 saat boyunca sütlerini sağmaları ve atmaları önerilir.
Üreme yeteneği /Fertilite:
Hayvanlarda metamizol üreme toksisitesine neden olmaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Önerilen dozaj sınırları içinde konsantrasyon ve reaksiyon yeteneği üzerinde bilinen herhangi bir istenmeyen etki yoktur. Ancak yine de, tedbir amaçlı olarak en azından yüksek dozlarda, konsantrasyon ve reaksiyon yeteneğinin bozulabileceği göz önünde bulundurulmalı ve araç ya da makine kullanımından ve diğer riskli aktivitelerden kaçınılmalıdır (özellikle de alkol kullanımı söz konusu ise).
4.8. İstenmeyen etkiler
Advers ilaç reaksiyonları aşağıdaki sıklık derecesine göre belirtilmiştir:
Çok yaygın(⥠1/10); yaygın (⥠1/100 ila < 1/10); yaygın olmayan (⥠1/1000 ila < 1/100); seyrek (⥠1/10000 ila < 1/1000); çok seyrek (< 1/10000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Seyrek: Lökopeni Çok seyrek: Ölümle sonuçlanabilen agranülositoz, trombositopeni Bilinmiyor: Aplastik anemi, ölümle sonuçlanabilen pansitopeni
Bunlar, daha önce hiçbir komplikasyon olmaksızın birçok kez ADEPİRON® kullanılmış olmasına rağmen yine de oluşabilir.
Bunlar nadir endikasyonlardır ve ADEPİRON® bir haftadan daha uzun süre kullanıldığında agranülositoz riski artabilir.
Bu reaksiyon doza bağlı değildir ve tedavi sırasında herhangi bir zamanda oluşabilir. Agranülositozun tipik belirtileri yüksek ateş, titreme, boğaz ağrısı, yutkunma güçlüğü ve ağız, burun, boğaz ve genital veya anal bölgede inflamasyondur. Ancak, antibiyotik tedavisi uygulanan hastalarda agranülositozun tipik belirtileri minimal düzeyde olabilir. Lenf nodlarında veya dalakta büyüme düşüktür ya da büyüme söz konusu değildir. Eritrosit sedimentasyon hızı çok artmıştır, granülositler belirgin derecede azalmış ya da tümüyle yok olmuştur. Her zaman olmamakla beraber genel olarak, hemoglobin, kırmızı hücreler ve trombosit değerleri normaldir (Bkz. Bölüm 4.4).
İyileşme için tedavinin derhal kesilmesi elzemdir. Dolayısıyla hastanın genel durumu beklenmedik biçimde kötüleşir, ateşi düşmez ya da yeniden yükselirse veya özellikle ağız, burun ve boğazda olmak üzere mukoz membranlarda ağrılı değişiklikler gözlemlenirse, diagnostik laboratuvar araştırma sonuçlarını beklemeksizin ADEPİRON® tedavisinin, derhal kesilmesi kesin bir şekilde önerilmektedir.
Deri ve mukoz membranlarda kanamaya eğilim ve peteşi trompositopeninin tipik belirtilerindendir.
Pansitopeni durumunda, tedavi derhal durdurulmalı ve normal değerlere dönünceye kadar tam kan sayımı takibi yapılmalıdır (Bkz. Bölüm 4.4).
Bağışıklık sistemi hastalıkları
Seyrek: Anafilaktik/anafilaktoid reaksiyonlar*
Çok seyrek: Analjezik kaynaklı astım sendromu. Analjezik astım sendromu olan hastalarda, bu intolerans reaksiyonları tipik olarak astım atakları şeklinde görülür.
Bilinmiyor: Anafilaktik şok*
*Bu reaksiyonlar özellikle parenteral uygulama sonrasında oluşabilir, şiddetli ve yaşamı tehdit eder bir hal alabilir ve bazen ölümle sonuçlanabilir. Bu reaksiyonlar ADEPİRON® daha önce defalarca hiçbir şikayete yol açmadan kullanılmış olsa bile ortaya çıkabilir.
Bu tür reaksiyonlar; metamizol uygulamasından hemen sonrasında ya da saatler sonra ortaya çıkabilir. Ancak buradaki olağan durum; uygulamadan sonraki ilk bir saat içinde reaksiyonun oluşmasıdır.
Daha hafif reaksiyonlar tipik olarak kutanöz ve mukozal semptomlar (kaşınma, yanma, kızarma, ürtiker, kabartılar gibi), dispne ve daha az sıklıkla gastrointestinal şikayetler halinde ortaya çıkar. Bu hafif reaksiyonlar zamanla jeneralize ürtiker, şiddetli anjiyoödem (hatta larinksi de kapsayacak şekilde), şiddetli bronkospazm, kardiyak aritmiler, kan basıncında düşüş (bazen öncesinde kan basıncı artışıyla) ve dolaşım şoku ile şiddetli formlara ilerleyebilir.
Dolayısıyla eğer cilt reaksiyonları gelişirse, ADEPİRON® tedavisi derhal durdurulmalıdır.
Kardiyak hastalıklar:
Bilinmiyor: Kounis sendromu
Vasküler hastalıklar
Yaygın olmayan: Uygulama esnasında ya da uygulama sonrası hipotansif reaksiyonlar (muhtemelen farmakolojik kaynaklı olan ve anafilaktik/anafilaktoid reaksiyonun diğer belirtilerini içermeyen). Bu tipte bir reaksiyon kan basıncında ciddi olabilecek bir düşüşe neden olabilir. Hızlı enjeksiyon bu gibi hipotansif reaksiyon oluşma riskini arttırır.
Yüksek ateş durumunda, aşırı duyarlılık reaksiyonunun herhangi bir başka belirtisi olmaksızın, kan basıncında doza bağlı olarak kritik bir düşüş de oluşabilir.
Gastrointestinal hastalıklar
Bilinmiyor: Gastrointestinal kanama vakaları bildirilmiştir.
Deri ve deri altı dokusu hastalıkları
Yaygın olmayan: Sabit ilaç erüpsiyonları Seyrek: Döküntü (örn. makülopapülöz döküntü)
Çok seyrek: Stevens-Johnson sendromu ya da Toksik Epidermal Nekroliz (tedaviyi durdurunuz, Bkz. Bölüm 4.4)
Böbrek ve idrar yolu hastalıkları
Çok seyrek: Böbrek fonksiyonunda akut kötüleşme çok nadir olarak oligüri, anüri veya proteinüri, ve/veya akut böbrek yetmezliği gelişebilir; akut interstisyel nefrit
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Enjeksiyon bölgesinde ağrı ve lokal reaksiyonlar meydana gelebilir. Tabloya çok nadir olarak flebit de eklenebilir.
Bazen idrarda kırmızı renklenme gözlenmiştir; bu, düşük konsantrasyonda bulunan bir metabolite (rubazonik asit) bağlı olabilir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmesi gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Belirtiler:
Akut doz aşımı sonrası bulantı, kusma, abdominal ağrı, böbrek fonksiyon bozukluğu/akut böbrek yetmezliği (örn. interstisyel nefrite bağlı olarak) ve daha nadir olarak merkezi sinir sistemi semptomları (baş dönmesi, somnolans, koma, nöbetler), kan basıncında düşüş ve ya bazen şok ve kardiyak aritmiler (taşikardi) bildirilmiştir. Çok yüksek dozlardan sonra, rubazonik asit atılımı sonucu idrar rengi kırmızıya dönebilir.
Tedavi:
Metamizolün bilinen spesifik bir antidotu yoktur. Eğer ilaç yeni alınmışsa, etkin maddelerin daha fazla sistemik emilimini sınırlamak amacıyla primer detoksifikasyona yönelik (örn. gastrik lavaj) ya da emilimi azaltıcı (örn. aktif kömür) önlemler alınabilir. İlacın ana metaboliti (4-N-metilaminoantipirin) diyaliz, hemofiltrasyon, hemoperfüzyon ya da plazma filtrasyonu yoluyla elimine edilebilir.
Zehirlenme tedavisi ve ciddi komplikasyonların önlenmesi, genel ve spesifik olarak yoğun medikal takip ve tedavi gerektirir.
Ciddi aşırı duyarlılık reaksiyonları (şok) oluşması durumda derhal alınması gereken tedbirler:
İlk belirtiler görüldüğünde (örn. ürtiker ve ciltte kızarma, huzursuzluk, baş ağrısı, terleme, bulantı gibi kutanöz reaksiyonlar), enjeksiyon durdurulmalıdır. Kanül damarda bırakılır veya damar giriş açılır. Baş ve üst gövdeyi alçaltmak, solunum yolu sağlamak ve oksijen uygulamayı içeren genel acil durum tedbirlerine ilave olarak, sempatomimetikler, volüm değiştirme veya glukokortikoidlerin kullanımı gerekli olabilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Analjezikler, Diğer Analjezikler ve Antipiretikler, Pirazolonlar
ATC Kodu: N02BB02
Metamizol analjezik, antipiretik ve antispazmodik özellikleri olan bir pirazolon türevidir.
Etki mekanizması tam olarak anlaşılamamıştır. Bazı araştırmaların sonuçları metamizol ve ana metabolitinin (4-N-metilaminoantipirin) kombine bir santral ve periferik etki modeline sahip olabileceğini göstermektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerMetamizol ve metabolitlerinin farmakokinetiği tam olarak açık değildir. Fakat aşağıdaki bilgiler verilebilir:
Emilim: Oral uygulamadan sonra metamizol tamamen aktif metaboliti olan 4-N- metilaminoantipirine (MAA) hidrolize olur. Metamizolün ana metaboliti MAA, karaciğerde oksidasyon, demetilasyon ve ardından asetilasyon ile daha fazla metabolize edilir. MAA'nın mutlak biyoyararlanımı yaklaşık olarak %90'dır ve oral uygulama sonrası intravenöz uygulamaya oranla biraz daha yüksektir. Metamizol besinlerle birlikte alındığında MAA'nın farmakokinetiği fark edilir bir değişikliğe uğramaz.
Biyotransformasyon: Klinik etkiyi temel olarak MAA ve bir dereceye kadar da 4- aminoantipirin (AA) sağlar. AA'nın EAA değerleri MAA'nın EAA değerinin yaklaşık %25'ini oluşturur. 4-N-asetilaminoantipirin (AAA) ve 4-N-formilaminoantipirin (FAA) gibi metabolitlerin klinik etkileri yok gibi görünmektedir. Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalışmaya ihtiyaç vardır. Kısa dönemli tedavide metabolitlerin birikiminin fazla bir klinik anlamı yoktur.
Dağılım: Proteine bağlanma düzeyleri MAA için %58, AA için %48, FAA için %18 ve AAA için %14'dür. Bir intravenöz doz sonrası metamizolün plazma yarılanma ömrü yaklaşık 14 dakikadır. Metamizol plasenta bariyerini geçer.Metabolitleri emziren annelerin sütüne geçer.
Eliminasyon: Radyoaktif işaretli intravenöz dozun yaklaşık %96'sı idrar, yaklaşık %6'sı ise
feçes yoluyla atılır. Tek bir oral dozdan sonra metabolitlerin %85'i idrarla atılmış ve bunun
%3±%l'i MAA, %6±%3'ü AA, %26±%8'i AAA ve %23±%4'ü FAA'dan oluşmuştur, l g'lık tek bir oral metamizol dozundan sonra renal klirens MAA için 5 ml±2 ml/dak., AA için 38 ml±13 ml/dak., AAA için 61 ml±8ml/dak., ve FAA için 49 ml±5 ml/dak olmuştur. Aynı dozdan sonraki plazma yarılanma ömürleri de MAA için 2,7±0,5 saat, AA için 3,7 ±1,3 saat, AAA için 9,5±1,5 saat ve FAA için 11,2±1,5 saat olmuştur.
Doğrusallık/doğrusal olmayan durum: Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalışmaya ihtiyaç vardır.
Hastalardaki karakteristik özellikler
Geriatrik popülasyon:
Yaşlı hastaların tedavisinde EAA 2-3 kat artar. Karaciğer sirozu olan hastalarda, tek doz oral uygulama sonrasında MAA ve FAA'nın yarılanma ömrü yaklaşık 3 kat artarken AA ve AAA'nın yarılanma ömürleri aynı dereceye yükselmez. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Pediyatrik popülasyon:
Çocuklarda metabolitlerin eliminasyonu yetişkinlerdekinden daha hızlıdır.
Karaciğer yetmezliği:
Karaciğer sirozu olan hastalarda, tek dozluk oral uygulama sonrasında, MAA ve FAA'nın yarılanma ömrü 3 kat artmıştır, ancak AA ve AAA'daki artış bu kadar belirgin olmamıştır. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Böbrek yetmezliği:
Böbrek fonksiyonu bozulmuş olan hastalara ait mevcut veriler bazı metabolitler için (AAA ve FAA) eliminasyonun azaldığını göstermektedir. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Biyoyararlanım:
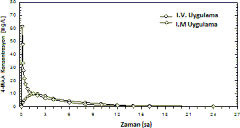
1987'de 12 gönüllü ile gerçekleştirilen, film kaplı tabletlerin referans ürünle (2 dakikalık IV uygulama) karşılaştırıldığı bir biyoyararlanım araştırmasında, 4-MAA için aşağıdaki sonuçlar gösterilmiştir:
| i.m. uygulama (1 g) | i.v. uygulama (1 g) |
Doruk plazma konsantrasyonu (Cmax) [mg/l] | 11,4±3,12 | 62,1 ± 15,9 |
Doruk plazma konsantrasyonu süresi (tmax) [s] | 1,67 ± 0,69 | 0,09 ± 0,02 |
Konsantrasyon-zaman eğri altı alan (EAA) [mg s/l] | 64,1 ± 14,8 | 67,8 ± 16,1 |
(Değerler ortalama ve standart sapma olarak gösterilmektedir)
I.M. solüsyonunun 4-MAA plazma konsantrasyonu için EAA ile ölçülen mutlak biyoyararlanımı %87 olmuştur.
Şekil 3: Konsantrasyon-zaman grafiğinde ortalama plazma eğrilerinin referans ürünle karşılaştırılması
5.3. Klinik öncesi güvenlilik verileri
Kronik toksisite
Farklı hayvan türlerinde subkronik ve kronik toksisite çalışmaları gerçekleştirilmiştir. Sıçanlarda 6 ay süreyle günlük 100-900 mg/kg vücut ağırlığı dozunda metamizol uygulanmıştır. En yüksek dozda (900 mg/kg), 13. haftadan sonra retikülositlerde ve Heinz cisimciklerinde artış saptanmıştır.
Köpeklerde 6 ay süreyle günlük 30-600 mg/kg vücut ağırlığı dozlarında metamizol uygulanmıştır. Günde 300 mg/kg dozlarından itibaren, doza bağlı hemolitik anemi ve böbrek ve karaciğer işlevlerinde bozulma gözlenmiştir.
İn vitro ve in vivo deneyler, aynı test sistemlerinde metamizol için çelişkili sonuçlar vermiştir.
Karsinojenite
Sıçanlarda yapılan uzun süreli çalışmalarda karsinojenik potansiyeli gösteren bir bulguya rastlanmamıştır. Uzun süreli üç çalışmadan ikisinde, yüksek dozlarda karaciğer hücreli adenomlarda artış bildirilmiştir.
Üreme Toksisitesi
Sıçan ve tavşanlarda yapılan embriyotoksisite çalışmalarında teratojenik potansiyel
gösterilmemiştir.
Tavşanlarda, maternal toksisite göstermeyen 100 mg/kg/gün dozunda letal etkiler bildirilmiştir. Sıçanlarda fatal embriyotoksik etkiler, maternal toksisite gözlenen doz aralığında ortaya çıkmıştır. Sıçanlarda 100 mg/kg/gün'ün üzerindeki dozlar, gestasyon süresinde uzama ve doğum sürecinde bozulmayla beraber, yavrularda mortalite artışına neden olmuştur.
Fertilite testlerinde, 250 mg/kg/gün'ün üzerindeki dozlarda döl veren jenerasyonun gebelik oranında hafif bir azalma gösterilmiştir. F1 jenerasyonun fertilitesi etkilenmemiştir.
Metamizol metabolitleri anne sütüne geçmektedir. Emzirenlerdeki etkilerine dair bir bilgi mevcut değildir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Enjeksiyonluk distile su
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
60 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığındasaklayınız.
6.5. Ambalajın niteliği ve içeriği
Kutuda, 5, 10 ve 100 adet 2 ml'lik bal rengi cam ampul içerisinde kullanıma sunulmuştur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve âAmbalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ANDOLOR | 8699508750016 | 104.78TL |
| DEVALJIN | 8699525750341 | 92.01TL |
| GERALGINE-M | 8681023750022 | |
| KAFALGIN | 8699550010090 | |
| KARMIZOL | 8680530620026 | |
| Diğer Eşdeğer İlaçlar |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
İLAÇ GENEL BİLGİLERİ
Adeka İlaç ve Kimyasal Ürünler San. Ve Tic. A.Ş.
| Geri Ödeme Kodu | A00371 |
| Satış Fiyatı | 138.62 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 138.62 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699587751881 |
| Etkin Madde | Metamizol Sodyum |
| ATC Kodu | N02BB02 |
| Birim Miktar | 500 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 10 |
| Sinir Sistemi > NONNARKOTİK ANALJEZİKLER > Metamizol Sodyum |
| Yerli ve Beşeri bir ilaçdır. |