APIDRA 100 U/ml SOLOSTAR SC kullanım için enjeksiyonluk çözelti(5 enjeksiyon kalemi) Kısa Ürün Bilgisi
{ Insulin Glusilin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
APİDRA® SoloStar® 100 U/ml Subkutan kullanım için enjeksiyonluk çözelti2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her bir ml, 100 U insülin glulisin (3.49 mga eşdeğer) içermektedir.
Her bir kalem, 300 Uye eşdeğer, 3 ml enjeksiyonluk çözelti içermektedir.
İnsülin glulisin rekombinant DNA teknolojisi ile Escherichia colide üretilmektedir.
Sodyum klorür 5.00 mg/ml
Sodyum hidroksit k.m. pH 7.3
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Kullanıma hazır enjeksiyon kalemi içinde enjeksiyonluk çözelti Berrak, renksiz, sulu çözelti
4.1. Terapötik endikasyonlar
4.2. Pozoloji ve uygulama şekli
Pozoloji:
Bu preparatın potensi ünitelerle ifade edilir. Bu üniteler APİDRA®ya özeldir ve diğer insülin analoglarının potensini belirtmek için kullanılan üniteler veya IU ile aynı değildir. Bkz. Bölüm 5.1. Farmakodinamik Özellikler.
Uygulama sıklığı ve süresi:
Öğünlerden kısa süre (0-15 dakika) önce ya da hemen sonra verilmelidir.
Orta veya uzun etkili bir insülin ya da bazal insülin analogu içeren rejimlerde kullanılmalıdır ve oral hipoglisemik ajanlarla birlikte kullanılabilir.
APİDRA® dozajı her bir hasta için bireysel olarak ayarlanmalıdır.
Uygulama şekli:
®
APİDRA®, subkutan enjeksiyonla ya da devamlı subkutan pompa infüzyonuyla verilmelidir.
®
APİDRA®, karın duvarı, uyluk bölgesi veya deltoide subkutan olarak veya karın duvarına devamlı infüzyon yoluyla uygulanmalıdır. Tüm insülinlerde olduğu gibi, bir enjeksiyon bölgesi içindeki (karın, uyluk bölgesi veya deltoid) enjeksiyon yerleri her enjeksiyonda dönüşümlü olarak kullanılmalıdır. Tüm insülinlerde olduğu gibi, emilim hızı ve dolayısıyla etki başlangıcı ve süresi, enjeksiyon yeri, egzersiz ve diğer değişkenlerden etkilenebilir. Karın duvarına yapılan subkutan enjeksiyon, diğer bölgelere göre daha hızlı emilir. (Bkz. Bölüm
5.2.)
Kan damarına girilmediğine dikkat edilmelidir. Enjeksiyondan sonra, enjeksiyon yerine masaj yapılmamalıdır. Hasta uygun enjeksiyon tekniklerinin kullanımı konusunda eğitilmelidir.
İnsülinlerle karıştırma:
®
Geçimlilik çalışmalarının yokluğundan dolayı, APIDRA , NPH (Neutral Protamin Hagedorn)
insan insülininden başka preparatlarla karıştırılmamalıdır.
®
SoloStar ı kullanmadan önce Kullanma Talimatındaki kalemin kullanımı dikkatlice okunmalıdır. (Bkz. Bölüm 6.6)
Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda insülin glulisinin farmakokinetik özellikleri genel olarak aynı kalmıştır. Ancak, böbrek yetmezliğinin varlığında insülin gereksinimi azalabilir. (Bkz. Bölüm 5.2)
Karaciğer yetmezliği
Karaciğer fonksiyon düşüklüğü olan hastalarda insülin glulisinin farmakokinetik özellikleri araştırılmamıştır. Karaciğer yetmezliği olan hastalarda, azalan insülin metabolizması ve azalan glikojen kapasitesi nedeniyle insülin gereksinimi azalabilir.
Pediyatrik Popülasyon
APlDRA®nın 6 yaşından küçük çocuklarda kullanımıyla ilgili yetersiz klinik bilgi mevcuttur.
Geriyatrik Popülasyon
4.3. Kontrendikasyonlar
4.4. Özel kullanım uyarıları ve önlemleri
Bir hastada yeni bir insülin tipi ya da markasına geçilmesi sıkı tıbbi gözetim altında gerçekleştirilmelidir. Doz, marka (üretici), tip (regüler, nötral protamin Hagedorn [NPH], lente, v.s.), tür (hayvan) ve/veya üretim yöntemindeki değişiklikler, dozajda bir değişikliğe yol açabilir. Birlikte kullanılan oral antidiyabetik tedavinin ayarlanması gerekebilir.
Özellikle insülin bağımlı diyabetlilerde, yetersiz doz kullanımı veya tedaviye devam etmemek, hayatı tehdit edici olabilen, hiperglisemi ve diyabetik ketoasidoza neden olabilir.
Hipoglisemi
Hipogliseminin gelişme zamanı, kullanılan insülinin etki profiline bağlıdır ve dolayısıyla, tedavi rejimi değiştiğinde değişebilir.
Hipogliseminin erken uyarı semptomları aşağıdaki durumlarda değişebilir ya da daha az belirgin olabilir: Uzun süreli diyabet, yoğun insülin tedavisi, diyabetik sinir hastalıkları, beta blokörler gibi ilaçlar veya hayvan kaynaklı insülinden insan insülinine geçişten sonra.
Hastaların fiziksel aktivitesinin artması ya da olağan öğün planlarının değişmesi halinde dozaj ayarlaması gerekebilir. Yemekten hemen sonra yapılan fiziksel aktivite hipoglisemi riskini artırabilir.
Çözünür insan insülini ile karşılaştırıldığında, hızlı etkili analogların enjeksiyonundan sonra hipoglisemi daha erken meydana gelir.
Düzeltilmeyen hipoglisemik veya hiperglisemik reaksiyonlar, bilinç kaybı, koma veya ölüme sebebiyet verebilir.
Insülin gereksinimleri hastalık sırasında veya duygu durumu rahatsızlıklarında değişebilir. Kalemin Kullanımı
SoloStar® ı kullanmadan önce, Kullanma Talimatındaki kalemin kullanımı dikkatlice
®
okunmalıdır. SoloStar , kalemin kullanımı bölümünde tavsiye edildiği gibi kullanılmalıdır (Bkz. Bölüm 6.6).
4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleri
Farmakokinetik çalışmalarda etkileşimlere bakılmamıştır. Benzer ilaç ürünlerine ait ampirik bilgilere dayanarak, klinik olarak anlamlı farmakokinetik etkileşimlerin oluşması olası değildir.
Bir dizi madde glukoz metabolizmasını etkiler ve insülin glulisin dozunun ayarlanmasını ve özellikle de yakından izlemeyi gerektirebilir.
Kan şekerini düşürücü etkiyi yükseltebilecek ve hipoglisemi duyarlılığını artırabilecek maddeler; oral antidiyabetikler, anjiotensin dönüştürücü enzim (ADE) inhibitörleri, disopiramid, fibratlar, fluoksetin, monoamin oksidaz inhibitörleri (MAOI), pentoksifilin, propoksifen, salisilatlar veya sülfonamid antibiyotikleri.
Kan-şekerini düşürücü etkiyi azaltabilecek maddeler; kortikosteroidler, danazol, diazoksid, diüretikler, glukagon, isoniazid, fenotiazin türevleri, somatropin, sempatomimetik ajanlar (örn. epinefrin [adrenalin], salbutamol, terbutalin), tiroid hormonları, östrojenler, projestinler (örn. oral kontraseptifler), proteaz inhibitörleri ve atipik antipsikotik ilaçlar (örn. olanzapin ve klozapin)
Beta-blokörler, klonidin, lityum tuzları veya alkol insülinin kan şekerini düşürücü etkisini kuvvetlendirebilir veya zayıflatabilir. Pentamidin hipoglisemiye yol açabilir ve bazen bunu hiperglisemi izleyebilir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi Cdir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Hayvan çalışmaları, gebelik embriyo/fetüs gelişimi, doğum veya postnatal gelişim açısından APİDRA® ile insan insülini arasında herhangi bir farklılık ortaya koymamıştır (Bkz. Bölüm 5.3). Gebe kadınlara verilirken tedbirli olunmalıdır. Glukoz kontrolünün dikkatle izlenmesi şarttır.
Gebelik dönemi
Gebe kadınlarda insülin glulisin kullanımına ilişkin yeterli klinik veri bulunmamaktadır. Önceden var olan veya gestasyonal diyabeti olan hastalarda tüm gebelik süresince iyi metabolik kontrolün sağlanması önemlidir. İnsülin ihtiyacı ilk trimesterde azalır, ancak genellikle ikinci ve üçüncü trimesterde artar. Doğumdan hemen sonra, insülin gereksinimi hızla düşer.
Laktasyon dönemi
4.7. Araç ve makine kullanımı üzerindeki etkiler
Hipoglisemi, hiperglisemi veya örn. görme bozukluğunun bir sonucu olarak hastanın konsantre olma ve tepki verme yeteneği etkilenebilir. Bu durum, bu yeteneklerin özellikle önemli olduğu (örn. araç veya makine kullanma gibi) durumlarda bir risk oluşturabilir.
4.8. İstenmeyen etkiler
İnsülin tedavisinin en sık görülen ve istenmeyen etkisi olan hipoglisemi, verilen insülin dozunun gereksinimden yüksek olması halinde meydana gelebilir.
Klinik araştırmalardan, ilgili advers reaksiyonlar sistem organ sınıfına ve azalan sıklığa göre aşağıda sıralanmıştır: (Sıklıklar; çok yaygın: >1/10; yaygın: >1/100 - <1/10; yaygın olmayan: >1/1.000 - <1/100; seyrek: >1/10.000 - <1/1.000; çok seyrek: <1/10.000 - bilinmeyen) (Elde edilebilir verilerden hesaplanamaz).
Her bir sıklık grubunda, istenmeyen etkiler azalan ciddiliğe göre sunulmaktadır.
Metabolizma ve beslenme bozuklukları
Çok yaygın: Hipoglisemi semptomları genellikle ani olarak ortaya çıkar. Soğuk terleme, beniz solgunluğu, halsizlik, sinirlilik veya titreme, anksiyete, alışılmamış yorgunluk veya zayıflık, konfüzyon, konsantrasyon bozukluğu, uyuşukluk, aşırı açlık, görme değişikliği, baş ağrısı, mide bulantısı ve çarpıntı.
Hipoglisemi ciddi boyuta gelebilir ve bilinç kaybı ve/veya konvülsiyona neden olabilir ve beyin fonksiyonlarında geçici veya kalıcı hasara yol açabilir, hatta ölümle sonuçlanabilir.
Deri ve subkutan doku bozuklukları
Yaygın: enjeksiyon yeri reaksiyonları ve lokal hipersensitivite reaksiyonları. Lokal hipersensitivite reaksiyonları (enjeksiyon yerinde kızarıklık, şişkinlik ve kaşıntı) insülinle tedavi sırasında oluşabilir. Bu reaksiyonlar genellikle geçicidir ve normal olarak tedavinin devamında ortadan kalkar.
Seyrek: Lipodistrofi
Lipdistrofi belli bir alanda, enjeksiyon yerinin değiştirilmediği durumlarda meydana gelebilir.
Genel bozukluklar
Yaygın olmayan: Sistemik hipersensitivite reaksiyonları.
Sistemik hipersensitivite reaksiyonları, ürtiker, göğüs sıkışması, dispne, alerjik dermatit ve kaşıntıdır. Anaflaktik reaksiyonlar içeren şiddetli alerjik durumlar hayatı tehdit edici olabilir.
Yaralanma, zehirlenme ve prosedürel komplikasyonlar
4.9. Doz aşımı ve tedavisi
Hipoglisemi, gıda alımmı ve enerji tüketimine oranla fazla insülin etkinliğinin bir sonucu olarak meydana gelebilir.
Insülin glulisin doz aşımına ait spesifik veri mevcut değildir. Ancak takip eden aşamalar sonrasında hipoglisemi gelişebilir:
Hafif dereceli hipoglisemi epizodları genellikle glukoz ve şekerli ürünlerin oral olarak uygulanması ile tedavi edilebilir. Bu nedenle diyabet hastalarının yanlarında şeker, tatlı besin, bisküvi veya şekerli meyve suyu bulundurmaları tavsiye edilir.
Hastanın bilinç kaybına neden olan ciddi hipoglisemi epizodları eğitimli bir kişi tarafından intramüsküler veya subkutan olarak verilen glukagon (0.5 - 1 mg) ile veya bir sağlık mesleği mensubu tarafından intravenöz olarak verilen glukoz ile de tedavi edilir. Eğer hasta glukagona 10-15 dakika içinde tepki vermez ise intravenöz olarak glukoz da uygulanmalıdır. Bilincin geri gelmesinden sonra, nüksü engellemek için oral karbonhidrat uygulaması tavsiye edilmektedir.
Glukagon enjeksiyonundan sonra, hastanın ciddi hipoglisemi nedenlerini tespit etmek ve benzer epizodları engelleyebilmek için, hasta bir hastanede gözetim altına alınmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: hızlı etkili insülin ve analogları. ATC kodu: A10AB06
İnsülin glulisin, regüler insan insülini ile eşit etki gücüne sahip bir rekombinant insan insülini analogudur.
İnsülinler ve insülin glulisin gibi insülin analoglarının birincil etkinliği, glukoz metabolizmasının düzenlenmesidir. İnsülinler özellikle iskelet kası ve yağ dokusu tarafından periferik glukoz alınımım uyararak ve hepatik glukoz üretimini inhibe ederek kan glukoz düzeylerini düşürür. İnsülin adipositte lipolizi inhibe eder, proteolizi inhibe eder ve protein sentezini arttırır.
Sağlıklı gönüllülerde ve diyabet hastalarında yapılan araştırmalar, subkutan uygulandığında insülin glulisinin regüler insan insülinine kıyasla etkisinin daha hızlı başladığını ve etki süresinin daha kısa olduğunu kanıtlamıştır. İnsülin glulisin subkutan olarak enjekte edildiğinde, glukozu düşürücü etkinliği 10-20 dakika içinde başlayacaktır. İntravenöz yoldan uygulandıklarında, insülin glulisin ve regüler insan insülinin glukozu düşürücü etkinliği eşit güçtedir. Bir ünite insülin glulisin bir ünite regüler insan insülini ile aynı glukoz düşürücü etkiye sahiptir.
Doz orantılılığı
21-50 yaşlarındaki tip 1 diyabetes mellituslu 18 erkek gönüllü ile yapılan çalışmada, insülin 0.075-0.15 U/kg olan terapötik uygun doz aralığında doza orantılı glukoz düşürücü etki göstermiştir. Kan glukozu düşürücü etkisi, insan insülini gibi 0.3 U/kg veya daha yüksek dozlarda orantısal artıştan daha az olmuştur.
İnsülin glulisin regüler insan insülininden yaklaşık iki kez daha hızlı etki eder ve regüler insan insülininden yaklaşık 2 saat önce glukoz düşürücü etkiyi tamamlar.
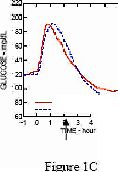
Tip 1 diabetes mellitusu olan hastalarda yapılan bir faz I araştırmada, 15 dakikalık standart bir öğünle ilişkili olarak farklı saatlerde, 0.15 U/kg dozunda subkutan olarak uygulanan insülin glulisin ve regüler insan insülininin glukozu düşürme profilleri değerlendirilmiştir. Elde edilen veriler, öğünden 2 dakika önce uygulanan insülin glulisinin, öğünden 30 dakika önce uygulanan regüler insan insülini ile benzer postprandiyal glisemik kontrol verdiğini işaret etmektedir. İnsülin glulisin öğünden 2 dakika önce uygulandığında, yemeklerden 2 dakika önce verilen regüler insan insülininden daha iyi postprandial glisemik kontrol sağlamıştır. Öğüne başlandıktan 15 dakika sonra uygulanan insülin glulisin, öğünden 2 dakika önce uygulanan regüler insan insülini ile benzer postprandial glisemik kontrol sağlamaktadır. (Bkz. Şekil 1)
T)
r im
uc 1j[ 1CC
su
60
i ı i i r | 1 1 |
- | |
ti \ * -V? Vs | |
IH | |
- - | pre" |
----^Ei-.^ 1 1 1 ■ 1 1 | 3ömh 1 1 |
-151 : [ i i Timi - TCU-
Fiaııre 1 A
GLLUSNE -pof -REIÖULM1 -ere
an
1B3 g 1B3
I
o 1DQ
B0 63
1 1 1 1 1 | 1 1 |
: L\ | - |
Tf \ A \ ı 1 \ ■■ f Tl _( V \ | - |
. - ÜLJJSIhF | - |
---- R=QLL*fl ..... | ere ı |
HME ■ -cu-
r
Fimıe İB
Şekil 1: Tip 1 diyabetli 20 hastada 6 saatten daha uzun süre ortalama glukoz düşürücü etki. Öğüne başlamadan 2 dakika önce verilen insülin glulisin (GLULISINE pre) ile öğüne başlamadan 30 dakika önce verilen insan insülini (REGULAR 30 dak) kıyaslaması (Şekil 1A) ve bir öğüne başlamadan 2 dakika önce verilen regüler insan insülini (REGULAR pre) ile kıyaslaması (şekil 1B) de gösterilmektedir. Öğüne başladıktan 15 dakika sonra verilen insülin glulisin ile (GLULISINE post) bir öğüne başlamadan 2 dakika önce verilen regüler insan insülini (REGULAR pre) ise şekil 1Cde gösterilmektedir. X-ekseninde ok ile belirtilen sıfır noktası 15 dakikalık öğünün başlangıcıdır.
Obezite
Insülin glulisin, lispro ve regüler insan insüliniyle obez bir popülasyonda yapılan, bir Faz I çalışması, insülin glulisinin hızlı-etki özelliğini devam ettirdiğini göstermiştir. Bu çalışmada erken glukoz düşürücü etkiyi temsil eden toplam eğri altındaki alanın (AUC) % 20sine ulaşana kadara geçen zaman ve eğri altında kalan alan [AUC (0-2 st)] insülin glulisin için sırasıyla 114 dakika ve 427 mg/kg-1; lispro için 121 dakika ve 345 mg.kg-1; regüler insan insülini için ise 150 dakika ve 197 mg.kg-1 olarak bulunmuştur (bakınız Şekil 2).
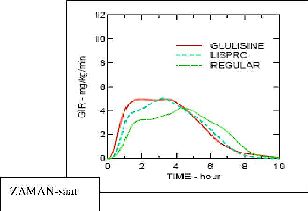
Şekil 2: Obez popülasyona subkutan olarak 0.3 U/kg dozda insülin glulisin (GLULISINE) veya insülin lispro (LISPRO) veya regüler insan insülini (REGULAR) uygulandıktan sonraki glukoz infüzyon oranları
İnsülin glulisin ve insülin lispro ile diyabetli olmayan ve vücut kitle indeksleri geniş bir aralığa dağılmış olan (18-46 kg/m2) 80 gönüllüde yapılan diğer bir Faz I çalışmasında, glukozu düşürücü toplam etkinin obezite arttıkça azalırken böylesine geniş bir vücut kitle indeksi aralığında dahi genel olarak hızlı etkinin devam ettirildiği gösterilmiştir.
0.2 ve 0.4 U/kg insülin glulisin için 0-1 saat arası toplam glukoz infüzyon oranı eğri altındaki alan değerleri (AUC) sırasıyla 102±75 mg/kg ve 158±100 mg/kg olarak bulunmuştur. Bu değerler, 0.2 ve 0.4 U/kg insülin lispro için ise sırasıyla 83.1±72.8 mg/kg ve 112.3±70.8 mg/kg olarak saptanmıştır.
Tip 2 diabetes mellitusu olan 18 obez hastada (VKİ 35 ile 40 kg/m2 arasında) insülin glulisin ve insülin lispro ile yapılan bir Faz I çalışmasında [% 90 lık güvenirlik aralığı: 0.81, 0.95 (p=<0.01)] insülin glulisinin gün içindeki öğün-sonrası kan glukozu iniş çıkışlarını etkin şekilde kontrol altına aldığı gösterilmiştir.
Klinik çalışmalar
Tip 1 diabetes mellitus - Erişkinler
Bazal insülin olarak insülin glarjin kullanan tip 1 diabetes mellitus hastalarında her ikisi de bir öğünden kısa süre önce (0-15 dakika) subkutan olarak enjekte edilen insülin glulisin ile insülin lisproyu karşılaştıran 26 haftalık bir faz III klinik çalışmada, insülin glulisin, glikozillenmiş hemoglobinde (HbA1c eşdeğeri olarak ifade edilen) başlangıç ile sonlanım noktası arasındaki değişikliklerle yansıtılan glisemik kontrol açısından insülin lispro ile benzer bulunmuştur. Kendi kan glukozunu izleme değerlerinin benzer olduğu gözlenmiştir. İnsülin lispronun tersine, insülin glulisin ile bazal insülin dozunda hiçbir artış gerekmemi ştir.
Bazal tedavi olarak insülin glarjin almakta olan tip 1 diabetes mellitus hastalarında gerçekleştirilen 12 haftalık bir faz III klinik çalışma, öğünden hemen sonra uygulanan insülin glulisinin öğünden hemen önce (0-15 dakika) uygulanan insülin glulisin ya da regüler insüline (30-45 dakika) benzer etkinlik sağladığını göstermektedir.
Her bir protokol popülasyonunda, öğün öncesi glulisin grubunda regüler insülin grubuna kıyasla GHbde anlamlı ölçüde daha büyük azalma gözlenmiştir.
Tip 1 diabetes mellitus - Pediyatrik
26 haftalık bir faz III klinik çalışmada, bazal insülin olarak insülin glarjin veya NPH kullanan tip 1 diabetes mellitus olan çocuklar (4-5 yaş: n=9; 6-7 yaş: n=32 ve 8-11 yaş : n=149) ve adolesanlarda (12-17 yaş: n=382) her ikisi de bir öğünden kısa süre önce (0-15 dakika) subkutan olarak enjekte edilen insülin glulisin ile insülin lispro karşılaştırılmıştır. İnsülin glulisin, kendi kan glukozunu izleme değerleri ile ve glikozillenmiş hemoglobinde (HbA1c eşdeğeri olarak ifade edilen GHb) başlangıç ile sonlanım noktası arasındaki değişikliklerle yansıtılan glisemik kontrol açısından insülin lispro ile benzer bulunmuştur.
6 yaşından küçük çocuklarda APİDRA® kullanımıyla ilişkili klinik bilgiler yetersizdir. Tip 2 diabetes mellitus - Erişkinler
Bazal insülin olarak NPH insülin de kullanan tip 2 diabetes mellitus hastalarında subkutan olarak enjekte edilen insülin glulisin (öğünden 0-15 dakika önce) ile regüler insan insülinini (öğünden 30-45 dakika önce) karşılaştırmak amacıyla, 26 haftalık bir faz III klinik çalışma ve ardından 26 haftalık bir uzatma güvenlilik çalışması yürütülmüştür. Hastaların ortalama vücut kitle indeksi (VKİ) 34.55 kg/m2 olarak bulunmuştur. İnsülin glulisinin, glikozillenmiş hemoglobinde (HbA1c eşdeğeri olarak ifade edilen) başlangıç ile 6 aylık sonlanım noktası arasındaki değişiklikler (insülin glulisin için -%0.46 ve regüler insan insülini için -%0.30, p=0.0029) ve başlangıç ile 12 aylık sonlanım noktası arasındaki değişiklikler (insülin glulisin için -%0.23 ve regüler insan insülini için -%0.13, fark anlamlı değil) açısından regüler insan insülini ile benzer olduğu gösterilmiştir. Bu çalışmada, hastaların çoğunluğu (%79) enjeksiyondan hemen önce kısa etkili insülinlerini NPH insülin ile karıştırmış ve hastaların %58i randomizasyon sırasında oral hipoglisemik ajanlar kullanmış ve bunları aynı dozda kullanmaya devam etmeleri öğütlenmiştir.
Irk ve cinsiyet
5.2. Farmakokinetik özellikler
Genel özellikler
İnsülin glulisinde, pozisyon B3de insan insülin amino asidi asparajinin yerini lizinin alması ve B29 pozisyonundaki lizinin yerini glutamik asidin alması daha hızlı emilime olanak sağlamaktadır.
Emilim ve biyoyararlanım:
Sağlıklı gönüllülerde ve diyabet hastalarındaki (tip 1 veya 2) farmakokinetik profiller, insülin glulisinin emiliminin regüler insan insülinine kıyasla yaklaşık iki kat daha hızlı ve doruk konsantrasyonunun yaklaşık iki kat daha yüksek olduğunu kanıtlamıştır.
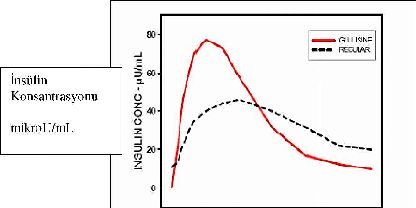
Tip 1 diyabeti olan hastalarda yapılan bir araştırmada, 0.15 U/kg dozun subkutan olarak uygulanmasından sonra, insülin glulisine için Tmax 55 dakika ve Cmax 82+ 1.3 mikroU/ml olarak ve regüler insan insülini için Tmax 82 dakika ve Cmax 46 + 1.3 mikroU/ml olarak bulunmuştur. İnsülin glulisinin ortalama kalış süresinin (98 dakika) regüler insan insülinine (161 dakika) kıyasla daha kısa olduğu saptanmıştır (Bakınız Şekil 3).
O 1 2 3 1 ç e
riMh-htur
ZAMAN-saat
Şekil 3: 0.15 U/kg dozda insülin glulisin ve regüler insan insülin uygulandıktan sonra Tip 1 diabetes mellituslu hastalardaki farmakokinetik profili.
Tip 2 diabetes mellituslu hastalarda yapılan bir çalışmada 0.2 U/kg dozda insülin glulisinin subkutan uygulanmasından sonra, C max değeri 91 ^U/ml olarak bulunmuştur, çeyrek değerler aralığı ise 78-104 ^U/ml arasında değişmiştir.
İnsülin glulisin karın, deltoid veya uyluk bölgesine subkutan olarak enjekte edildiğinde, konsantrasyon-zaman profilleri benzer bulunmuş; karına uygulandığında emilimin uyluk bölgesine uygulamaya kıyasla biraz daha hızlı olduğu saptanmıştır. Deltoid bölgesinden emilim ikisinin arasındadır (Bkz. Bölüm 4.2). İnsülin glulisinin mutlak biyoyararlanımı (%70) ve düşük bireyler arası değişkenliği (%11 CV) enjeksiyon bölgeleri arasında benzerdir.
Obezite
Vücut kitle indeksleri geniş bir aralığa dağılmış (18-46 kg/m2) diyabetli olmayan 80 gönüllüden oluşan bir popülasyonda insülin glulisin ve insülin lispro ile yapılan başka bir Faz I çalışmasında bu geniş aralıktaki vücut kitle indekslerinde de genellikle hızlı emilim ve toplam maruziyetin devam ettirildiği gösterilmiştir. İnsülin glulisin, toplam insülin maruziyetinin % 10una ulaşmak için geçen süreye yaklaşık 5-6 dakika daha erken ulaşmıştır.
Dağılım ve eliminasyon:
İntravenöz uygulamadan sonra insülin glulisin ve regüler insan insülininin dağılım ve eliminasyonu benzer olup, dağılım hacimleri sırasıyla 13 L ve 22 L ve yarılanma ömürleri sırasıyla 13 dakika ve 18 dakikadır.
Subkutan uygulamadan sonra, 86 dakikaya kıyasla 42 dakika gibi görünürdeki yarılanma ömrü değerleri ile, insülin glulisin regüler insan insülinine kıyasla daha hızlı eliminasyon göstermektedir. Sağlıklı gönüllülerde veya Tip 1 ya da Tip 2 diabetes mellituslu gönüllülerde
insülin glulisin ile yapılan bir çapraz çalışma analizinde, görünür yarılanma ömrü 37 dakika ile 75 dakika (çeyrek değerler aralığı) arasında değişmiştir.
Insülin glulisin tıpkı insan insülini gibi plazma proteinlerine düşük oranda bağlanmaktadır.
Doğrusallık/Doğrusal olmayan durum:
Yaşları 21 ile 50 arasında değişen, Tip 1 diabetes mellituslu 18 erkek gönüllüde yapılan bir çalışmada insülin glulisin, 0.075 U/kg ile 0.4 U/kg arasındaki doz aralığında, erken, maksimum ve toplam maruz kalma açısından doz-orantılılığı göstermiştir.
Hastalardaki karakteristik özellikler:
Böbrek Yetmezliği:
Geniş bir böbrek fonksiyonu aralığını (Kreatinin klerensi >80 ml/dakika, 30-50 ml/dakika, <30 ml/dakika) kapsayan, diyabetik olmayan bireylerde yapılan bir klinik araştırmada, insülin glulisinin hızlı etkiyen özellikleri genel olarak korunmuştur. Ancak böbrek yetmezliğinde insülin ihtiyacı azalabilir.
Karaciğer Yetmezliği:
Karaciğer yetmezliği olan hastalarda farmakokinetik özellikleri incelenmemiştir. Geriyatrik Popülasyon:
Diabetes mellituslu yaşlı hastalarda farmakokinetiği ile ilgili çok kısıtlı veri bulunmaktadır.
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi veriler, kan glukozunu düşürücü farmakodinamik etkinlikle (hipoglisemi) bağlantılı bulguların dışında, regüler insan insülininden farklı ya da insanlar için klinik anlam taşıyan herhangi bir toksisite bulgusu ortaya koymamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
6.2. Geçimsizlikler
Insülin glulisin ile geçimlilik çalışmaları olmadığından, NPH insan insülini hariç, diğer ilaçlarla karıştırılmamalıdır.
6.3. Raf ömrü
2 yıl
Kalemin ilk kullanımdan sonraki raf ömrü
Ürün doğrudan ısı veya ışığa maruz bırakılmadan ve 25 °Cnin altındaki oda sıcaklığında
maksimum 4 hafta süreyle saklanabilir.
Kullanılmakta olan kalemler buzdolabında saklanmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
Kullanılmayan kalemler:
Buzdolabında, 2 oC - 8 oCde saklayınız. Dondurmayınız. APlDRA®yı buzdolabında dondurucu bölme veya soğutma paketine yakın koymayınız. Işıktan korumak için karton kutusunun içinde saklayınız.
Kullanılmakta olan kalemler:
6.5. Ambalajın niteliği ve içeriği
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Ilk kullanımdan önce, kalemin 1-2 saat süreyle oda ısısında tutulmalıdır.
Kullanmadan önce kartuşu görsel olarak inceleyiniz. Yalnızca çözelti berrak, renksiz ise ve
®
gözle görülebilen katı partiküller içermiyorsa kullanılmalıdır. APIDRA bir çözeltidir, bu nedenle kullanmadan önce tekrar süspansiyon haline getirilmesi gerekmemektedir.
Boş kalemler asla kullanılmamalıdır ve uygun bir şekilde atılmalıdır.
Herhangi bir kontaminasyonu önlemek için, her bir kullanıma hazır enjeksiyon kalemi yalnız bir hasta tarafından kullanılmalıdır.
Insülin glulisin ve diğer insülinler arasındaki ilaç kullanım yanlışlığını önlemek için insülin etiketi her enjeksiyon öncesi kontrol edilmelidir.
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmelik"lerine uygun olarak imha edilmelidir.
Kalemin Kullanımı
SoloStar® kullanılmaya başlanmadan önce, Kullanma Talimatındaki kalemin kullanımı dikkatlice okunmalıdır.
Kalem
İğ
nesi (dahil de
ğ
il)
Kalem kapa
ğ
ı
Kalem gövdesi
i
nsülin haznesi
Doz penceresi
Kauçuk disk
Koruyucu disk
o
iğne
iç
kapağı - iğne
ıiulr-
ııccdll
İğ
ne dı
ş
kapa
ğ
ı
rijiuıt . ............
Dozaj Enjeksiyon dü
ğ
mesi
Enjeksiyon kaleminin şematik çizimi SoloStar®ın kullanımı için önemli bilgiler
Her kullanımdan önce her zaman yeni bir iğne dikkatlice takılmalı ve güvenlilik testi uygulanmalıdır. Sadece SoloStar® enjeksiyon kalemiyle uyumlu iğne kullanınız. İğne ile kazayla oluşacak yaralanmalardan ve enfeksiyon bulaşmasından kaçınmak için gereken önlemler alınmalıdır.
Eğer SoloStar® enjeksiyon kalemi zarar gördüyse veya düzgün bir şekilde çalıştığından emin değilseniz, kalemi kesinlikle kullanmayınız.
Kullandığınız SoloStar® enjeksiyon kaleminin kaybolma veya bozulma ihtimaline karşı, her
®
zaman yedek bir SoloStar® kalem bulundurunuz.
Saklanması
®
SoloStar enjeksiyon kaleminin saklanması ile ilgili talimatlar için, Bölüm 6.4e bakınız.
SoloStar® enjeksiyon kalemi soğukta saklandıysa, enjeksiyonu yapmadan 1-2 saat önce kaleminizi normal oda ısısına gelmesi için serin yerden çıkarınız. Soğuk insülin enjekte edildiğinde daha fazla acı verir.
Kullanılmış SoloStar® enjeksiyon kalemi "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmelik"lerine uygun olarak imha edilmelidir.
Bakımı
SoloStar® enjeksiyon kalemi kirden ve tozdan korunmalıdır.
SoloStar® enjeksiyon kaleminizin dışı nemli bir bezle silerek temizlenebilir.
Kaleminizi suya sokmayınız, yıkamayınız, yağlamayınız. Bu işlemler kaleminize zarar
verebilir.
SoloStar® enjeksiyon kalemi doğru ve güvenli çalışmak üzere tasarlanmıştır. Özenli kullanınız, kaleminizin zarar görebileceği durumlardan sakınınız. Kaleminizin hasar gördüğünden şüpheleniyorsanız, yeni bir SoloStar® enjeksiyon kalemi kullanınız.
1. Adım İnsülini kontrol ediniz
Doğru insülin olduğundan emin olmak için, kalem üzerindeki etiketi kontrol ediniz. APIDRA® SoloStar® mavi renklidir. Enjeksiyon düğmesi koyu mavi renktedir ve tepesinde bir halka bulunur. Kalemin kapağını çıkardıktan sonra, insülinin görünüşünün de kontrol edilmesi gerekir. Insülin çözeltisinin berrak ve renksiz olması, içinde görünür katı tanecik bulunmaması ve su gibi homojen olması gerekir.
2. Adım İğneyi takınız
Sadece SoloStar® enjeksiyon kalemiyle uyumlu iğnelerin kullanılması gerekir.
Her zaman her enjeksiyon için yeni bir steril iğne kullanılmalıdır. Kapak çıkarıldıktan sonra,
iğnenin dikkatlice ve dik bir şekilde tutularak kaleme takılması gerekir.
3. Adım Güvenlik testini yapınız
Her enjeksiyondan önce güvenlik testinin yapılması gerekir. 2 ünite doz seçiniz.
Iğnenin dış ve iç kapaklarının çıkarılmalıdır.
Iğne yukarıya doğru gelecek şekilde kalemi tutarken, parmakla insülin haznesine vurularak, hava kabarcıklarının iğneye doğru toplanması sağlanmalıdır.
Bundan sonra enjeksiyon düğmesine sonuna kadar basılmalıdır.
Eğer iğnenin ucundan insülin çıktıysa, kalem ve iğne doğru şekilde çalışmaktadır.
Eğer iğnenin ucundan hiç insülin çıkmadıysa, 3. adımda belirtilenleri iğnenin ucundan insülin
çıkana kadar tekrarlanmalıdır.
4. Adım Dozu seçiniz
Doz ayarlaması 1 ünitelik artışlar halinde yapılabilir. En az 1 ünite, en fazla 80 üniteye kadar doz seçilebilir. Eğer 80 üniteden daha fazla doza ihtiyaç varsa, iki veya daha fazla sayıda enjeksiyon ile verilmelidir.
Güvenlik testini yaptıktan sonra, doz penceresi "0" göstermelidir. Daha sonra doz seçilmelidir.
5. Adım İnsülin dozunun enjekte edilmesi
Hastaya bir sağlık mesleği mensubu tarafından enjeksiyon tekniği öğretilmelidir. Iğne deriye batırılmalıdır.
Enjeksiyon düğmesine sonuna kadar basılmalıdır. Iğne deri altından çıkarılmadan önce 10 saniye süreyle enjeksiyon düğmesi basılı tutulmalıdır. Böylece dozun tam olarak verildiği garanti altına alınmış olur.
6. Adım İğnenin çıkarılması ve atılması
Her zaman her enjeksiyondan sonra iğne çıkarılmalı ve uygun şekilde atılmalıdır. Bu şekilde bulaşma ve/veya enfeksiyon gelişmesi, insülin haznesine hava girmesi veya insülin kaçağı oluşması engellenmiş olur. Iğneler tekrar kullanılmamalıdır.
Iğneyi çıkarırken ve atarken dikkatli olunmalıdır. Iğne ile yaralanma veya enfeksiyon hastalığı bulaşması riskini azaltmak için, iğnelerin çıkarılması ve atılmasıyla ilgili (örneğin tek elle kapağın kapatılması tekniği gibi) tavsiye edilen güvenlilik önlemlerine uyunuz.
Kalemin ucuna kendi kapağı takılmalıdır.
İnsülinlerin karıştırılması
NPH insan insüliniyle karıştırılacağı zaman şırınga içine önce APIDRA®mn çekilmesi gerekir. Karıştırma yapıldıktan hemen sonra enjeksiyon gerçekleştirilmelidir; çünkü enjeksiyondan ne kadar zaman önce karışımların hazırlanması gerektiği hakkında hiç bir veri bulunmamaktadır.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Geri Ödeme Kodu | A10167 |
| Satış Fiyatı | 810.97 TL [ 5 Apr 2024 ] |
| Önceki Satış Fiyatı | 810.97 TL [ 1 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699809950665 |
| Etkin Madde | Insulin Glusilin |
| ATC Kodu | A10AB06 |
| Birim Miktar | 100 |
| Birim Cinsi | U/ML |
| Ambalaj Miktarı | 5 |
| Sindirim Sistemi ve Metabolizma > İnsülinler ve Analogları > Insülin GlulisineHızlı |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |